
题目列表(包括答案和解析)
12.下列关系的表述中,正确的是
A.0.1mol·L-1NaHSO4溶液中:c(Na+)+ c(H+)= c(SO42-)+c(OH-)
B.中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1∶1
C.pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)不相等
D.0.1mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
11.设阿伏加德罗常数的数值为nA,下列说法正确的是
A.1molNa2O2和水完全反应,转移电子数为2nA
 B.0.5L0.2mol·L-1FeCl3溶液中,含Fe3+ 离子数为0.1nA
B.0.5L0.2mol·L-1FeCl3溶液中,含Fe3+ 离子数为0.1nA
C.理论上氢氧燃料电池负极消耗11.2L标准状况下气体,外线路通过电子数为nA
D.常温常压下,28g乙烯和丙烯混合气体含有的碳原子总数为2.5nA
10.下列实验中,能达到预期目的的是
A.用过滤法除去Fe(OH)3胶体中的FeCl3
B.用25mL碱式滴定管量取20.00mLNa2CO3溶液
C.向某溶液中滴入BaCl2溶液和稀HNO3,来检验溶液中是否含有SO42-
D.将Na投入到CuSO4溶液中置换出铜,来证明钠的金属性比铜强
9.短周期元素A、B、C的原子序数依次递增,三者原子最外层电子数之和为14,A原子的次外层电子数等于B原子的最外层电子数,A与C同主族。则下列叙述正确的是
A.原子半径:A<B<C
B.氢化物稳定性:A<C
C.B与A的化合物比B与C的化合物熔点低
D.A与C的化合物属于大气污染物
8.下列说法中,错误的是
A.蔗糖、淀粉、纤维素水解的最终产物都是葡萄糖
B.误服重金属盐,立即服用牛奶或豆浆可解毒
C.油脂、乙酸乙酯都属于酯类,但不是同系物
D.煤的干馏可以得到苯、甲苯等芳香烃
7.下列叙述中,正确的是
①汽车尾气中的氮氧化物与光化学烟雾形成有关
②大量燃烧含硫燃料是形成酸雨的主要原因
③硅是制造太阳能电池和光导纤维的主要原料
④减少CO2排放,可遏制全球气候变暖
⑤纯铁比碳素钢易生锈
A.①③⑤ B.②③④ C.②④⑤ D.①②④
33.(16分) 乙酸苯甲酯可用作茉莉、白兰、月下香等香精的调合香料,它可以用甲苯和乙醇为原料进行人工合成,合成路线如下:
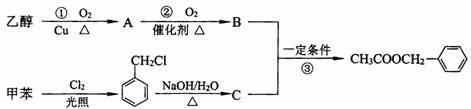
(1)C的结构简式为__________________________。
(2)反应②、③的反应类型为_______________,_______________。
(3)甲苯的一氯代物有 种。
(4)写出反应①的化学方程式_______________________________。
(5)为了提高乙酸苯甲酯的产率应采取的措施是(写一项)
。
广东省江门市20
10届高三调研测试
32.(15分)空气吹出法是目前从海水中提取溴的常用方法,流程如下(苦卤:海水蒸发结晶分离出食盐后的母液):
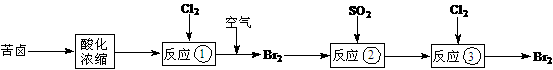
(1)反应①的离子方程式为 。
(2)反应②的离子方程式为 ,还原剂是 。
(3)实验室从反应③后的溶液中分离出单质溴的方法是 。
(4)苦卤还可以用来制取金属镁,用化学方程式或离子方程式表示从苦卤制取金属镁的反应原理 。
31.(15分) 联合国气候变化大会2009年12月7日在丹麦首都哥本哈根拉开帷幕,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
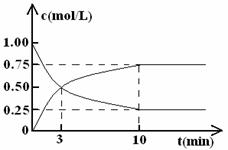
① 从反应开始到平衡,甲醇的平均反应速率v(CH3OH)= 。
②该反应的平衡常数表达式k= 。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 (填编号)。
A.将H2O(g)从体系中分离 B.充入He(g),使体系压强增大
C.升高温度 D.再充入lmolCO2和3molH2
(2)在载人航天器的生态系统中,不仅要求分离除去CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阴极反应为:
2CO2+4e-+2H2O=2CO+4OH- ,阳极反应式为: 。有人提出用反应2CO=2C+O2(△H>O、△S<0)来消除CO的污染,请你判断是否可行 ,并说出理由: 。
30.(18分)在两支试管中分别加入约1g的Na2CO3和NaHCO3固体,进行如下实验探究:
|
实验步骤 |
Na2CO3的现象 |
NaHCO3的现象 |
结论 |
|
①各滴入几滴水,振荡,触摸试管底部 |
|
无明显现象 |
|
|
②各再加入10mL水,振荡 |
|
仍有固体 |
|
|
③分别继续滴入1-2滴酚酞溶液 |
|
|
|
(1)完成上表空格
(2)现有一包白色粉末,请设计实验探究证明是NaHCO3。
可供选用的仪器和试剂:铁架台等固定装置、试管、酒精灯、坩埚、导管、带孔橡皮塞、铂丝、稀硫酸、稀盐酸、NaOH溶液、澄清石灰水。
|
实验操作 |
预期现象和结论 |
|
① |
|
|
② |
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com