
题目列表(包括答案和解析)
14.下列离子方程式中正确的是
A.FeBr2溶液中通入过量的Cl2 2Fe2++4Br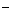 +3Cl2===2Fe3++2Br2+6Cl
+3Cl2===2Fe3++2Br2+6Cl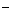
B.过量NaHSO4与Ba(OH)2溶液反应:Ba2++OH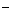 +H++SO
+H++SO ===BaSO4↓+H2O
===BaSO4↓+H2O
C.漂白粉溶液中通入过量的SO2:ClO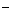 +SO2+H2O===HClO+HSO
+SO2+H2O===HClO+HSO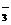
D.向FeI2溶液中通入Cl2至Fe2+恰好完全被氧化 2Fe2++Cl2===2Fe3++2Cl
13.已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A.该溶液的pH=4
B.此酸的电离平衡常数约为1×10-7
C.升高温度,溶液的pH增大
D.由HA电离出的c(H+)约为水电离出的c(H+)的10-6倍
12.在一定温度下,反应H2(g)+X2(g)HX(g)的平衡常数为10,若将1.0 mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
A.5% B.17% C.25% D.33%
11.某氢氧化钠溶液跟醋酸溶液混合后溶液呈酸性,则混合溶液中离子的物质的量浓度之间关系一定正确的是,
A.c(Na+)+c(H+)==c(CH3COO-)
B.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c ( CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.c(H+ ) == c(CH3COO-)-c(Na+)+ c(OH-)
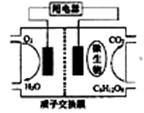
10.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
关于该电池的叙述正确的是:
A.该电池能够在高温下工作
B.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2 22.4/6 L
C.放电过程中,H+从正极区向负极区迁移
D.电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+
9. 已知反应mX(g)+nY(g)qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡,下列说法正确的是
已知反应mX(g)+nY(g)qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡,下列说法正确的是
 A.通入稀有气体使压强增大,平衡将正向移动。
A.通入稀有气体使压强增大,平衡将正向移动。
B.X的正反应速率是Y的逆反应速率的m/n倍。
C.降低温度,混合气体的平均相对分子质量变小。
D.增加X的物质的量,Y的转化率降低。
8.相同条件下,向100mL pH=1的硫酸、醋酸、盐酸溶液中分别加入0.46g Na,产生氢气的体积分别为V1、V2、V3,则下列关系中,正确的是
A.V3<V2<V1 B.V1=V2=V3 C.V1=V3>V2 D.V1=V3<V2
7.某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等7种离子中的几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断:该溶液中肯定不存在的离子是
A.Al3+、Mg2+、I-、SO32- B.Mg2+、Na+、CO32-、I-
C.Al3+、Na+、SO32-、I- D.Al3+、CO32-、Br-、SO32-
6.14g铜、银合金与足量的某浓度的硝酸反应,将放出的气体与1.12L(标准状况下)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量为
A.9.6g B.6.4g C.3.2g D.1.6g
5. 下列化学用语表示错误的是
下列化学用语表示错误的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com