
题目列表(包括答案和解析)
23.(16分)
I. 有机化合物A 一E的转化如下列反应框图所示,1molA和2molH2在一定条件下恰好反应,生成饱和一元醇X,X中碳元素的质量分数为65%。
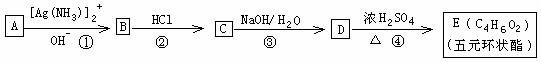
(1)X的分子式为____________________
(2)A分子中所含官能团的名称是_____________________________
(3)上述转化①一④步反应中,属于取代反应类型的是__________________
(4)C的结构简式为_________________________
(5)D→E的反应方程式为_________________________________
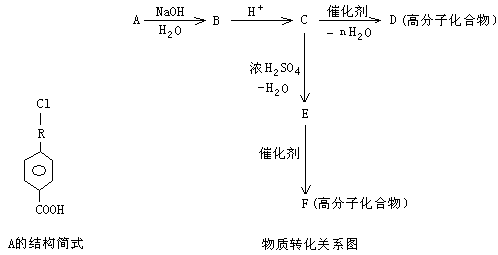 II 有机物A的相对分子质量为198.5,其结构简式如下(-R-代表某种烷基),已知在光照条件下,A分子中的一个氢原子被氯原子取代时只得到一种产物,A在一定条件下还有下图所示的反应关系:
II 有机物A的相对分子质量为198.5,其结构简式如下(-R-代表某种烷基),已知在光照条件下,A分子中的一个氢原子被氯原子取代时只得到一种产物,A在一定条件下还有下图所示的反应关系:
(1)A的分子式为______________
(2)A→B的化学方程式为________________________________________________
(3)写出E中所含官能团的名称____________________;C→D的反应类型_________________
22.(14分)
I. (1)玻璃棒是中学化学实验中常用的仪器。下列实验过程中,一般不需要用玻璃棒的是____________(填写编号)
① 用pH试纸测定Na2CO3溶液的pH
② 配制一定物质的量浓度的氯化钠溶液
③ 将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④ 探究Ba(OH)2·8H2O晶体与NH4Cl晶体反应过程中的能量变化
⑤ 实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2
(2)用“大于”“小于”或“等于”填空
① 读取量筒中液体体积时,视线偏高,读取的体积数____________实际体积数。
② 用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,所称取食盐的质量______10.4g
③ 配制500mL0.1mol/LNaOH溶液,定容时俯视刻度线,所得溶液的物质的量浓度____0.1mol/L
④ 用中和滴定测某NaOH溶液的浓度,量取待测液时未用该溶液润洗滴定管,测得的溶液浓度_______________实际溶液。
II 某同学设计了如下影响反应速率的实验(温度控制为25℃和35℃)。请你根据实验目的帮助该同学完成以下实验设计表(用量:酸均为50.0mL、铝为9.0g过量)
(1)
|
实验目的 |
编号 |
温度 |
铝形态 |
盐酸浓度 mol/L |
|
1. 实验①和②探究盐酸浓度对该反应速率的影响; 2. 实验①和③探究温度对该反应速率的影响; 3. 实验①和④探究金属规格(铝片、铝粉)对该反应速率的影响。 |
① |
25℃ |
铝片 |
4.0 |
|
② |
|
|
|
|
|
③ |
|
|
|
|
|
④ |
|
|
|
(2)下图为实验①的“H2-t”曲线图,若上述反应浓度减少一倍,速率是原来的1/2;温度每升高10℃,反应速率是原来的2倍。请在右图的坐标中画出实验②和实验③的“H2-t”曲线图。

21.(14分) 化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的可燃冰是高压下形成的外观像冰的甲烷水合物固体,被称之为“未来能源”。在25℃、101KPa下,1g甲烷完全燃烧生成二氧化碳和液态水时放热55.6KJ。甲烷燃烧的热化学方程式为:__________________________________________________________
相同条件下,356g可燃冰(分子式为CH4·9H2O)释放的甲烷气体完全燃烧生成二氧化碳和液态水,放出的热量为__________________KJ。
(2)二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。
① 写出两种与二甲醚相对分子质量相等且元素种类相同的有机物的结构简式:_________
② 二甲醚可由合成气(CO和H2)在一定条件下制得。用合成气制二甲醚时,还产生了一种可参与大气循环的无机化合物,该反应的化学方程式可能是:_______________
 ③ 以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是:____________________________________
③ 以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是:____________________________________
④ 在容积固定的密闭容器中进行化学反应: CO(g) + H2O(g) CO2 (g)+ H2 (g)
其化学平衡常数K和温度T的关系如下表:
|
T/℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
该反应的化学平衡常数表达式为K=_________。该反应的正反应是________热反应(填“吸”或“放”)
20.现有乙酸和两种链状单烯烃的混合物,若其中氧的质量分数为a,则碳的质量分数是
A.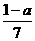 B.
B.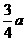 C.
C.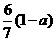 D.
D.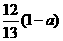
 学
学

II卷(60分) (请将答案写在答题纸上)
19.人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应: ,37 ℃时,该反应的平衡常数K=220 。
,37 ℃时,该反应的平衡常数K=220 。 的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
A.CO与 反应的平衡常数
反应的平衡常数
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
18. 用石墨作电极电解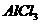 溶液时,下图所示的电解变化曲线合理的是
溶液时,下图所示的电解变化曲线合理的是
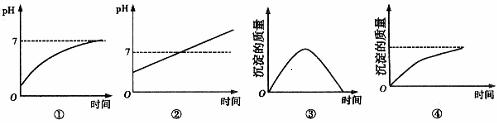
A.①④ B.②④ C.②③ D.①③
17.以铁为阳极、以铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2molFe(OH)3沉淀,此间共消耗水的物质的量为
A.3mol B.4mol C.5mol D.6mol
16.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是: A.氯碱工业电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2 ↑ B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH- C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu -2e- == Cu2+ D.钢铁发生电化腐蚀的正极反应式:Fe -2e- == Fe2+
15.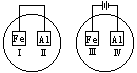 将Fe片和Al片放在盛有NaCl溶液(其中滴入酚酞)的表
将Fe片和Al片放在盛有NaCl溶液(其中滴入酚酞)的表
面皿中,如图表示,最先观察到变红色的区域为:
A.II和Ⅳ B.Ⅱ和Ⅲ C.Ⅰ和Ⅲ D.Ⅰ和Ⅳ
14.已知室温时,0.1mol/LCH3COOH在水中有0.1%发生电离,下列叙述错误的是:
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为10-7
D.由CH3COOH电离出的c(H+)约为水电离出的c(H+)的106倍
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com