
题目列表(包括答案和解析)
9.有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成:①CH3COONa与Na2CO3;②CH3COONa与NaCl;③CH3COONa与NaOH;④CH3COONa与HCl。C(CH3COO一)排序正确的是w.w.w.k.s.5.u.c.o.
A.③>①>②>④ B.③>②>①>④
C.④>②>①>③ D.④>②>③>①
8.乙酸橙花酯是一种食用香料,结构如下图所示。下列关于该物质的说法有
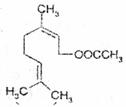 ①该化合物属于羧酸类.
①该化合物属于羧酸类.
②该化合物的分子式为C12 H18O2;
③一定条件下,1mol该化合物可与2 mol H2发生反应;
④该化合物能发生的反应类型有:加成、取代、氧化.酯化:
⑤该化台物不能有属于酚类的同分异构体。其中正确的是
A.①④ B.②③
C.④⑤ D.③⑤
7.下列离子方程式正确的是.
A.Fe(OH)3与氢溴酸溶液混合: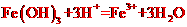
B.1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:
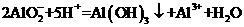
C.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液
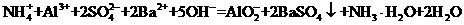
D.向Ca(C1O)2溶液中通入适量SO2: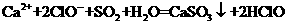
6.下列各组离子在指定溶液甲一定能大量共存的是
A.酸性溶液中: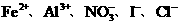
B.pH=13的溶液中: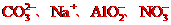 w.w.w.k.s.5.u.c.o.
w.w.w.k.s.5.u.c.o.
C.加入Al能放出H2的溶液中: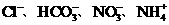
D.在由水电离出的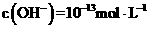 的溶液中:
的溶液中: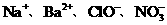
不定项选择题:本题包括6小题,每小题4分,共计24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题的0分;若正确答案包括两个选项,只选一个且正确的的2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
5.具备基本的化学实验技能是进行科学探究的基础和保证。下列有关实验操作正确的是
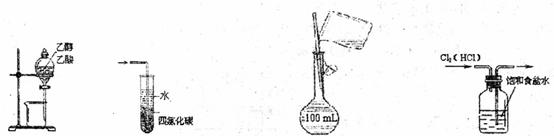
A.分离乙酸和乙醇 B.吸收氧化氨气体
C.配制150mL0.10mol·L-1盐酸 D.除去氯化氢中的氯气
4.用NA表示阿伏加德罗常数的值。下列叙述正确的是w.w.w.k.s.5.u.c.o.
A.常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.5ANA
B.标准状况下,2,24LCl2与过最稀NaOH溶液反应,转移的电子总数为0.2NA
C.标准状况下,22.4L苯中约含有6.02×1023个碳碳双键
D.常温常压下,1 mol甲基(一CH3)所含的电子数为10NA
3.下列现象或反应的原理解释正确的是 w.w.w.k.s.5.u.c.o.
|
选项 |
现象或反应 |
原理解释 |
|
A |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔对熔化的铝有较强的吸附作用 |
|
B |
合成氨反应需在高温条件下进行 |
该反应为吸热反应 |
|
C |
镀层破损后,镀锡铁比镀锌铁易腐蚀 |
锡比锌活泼 |
|
D |
2CO=2C+O2在任何条件下均不能自发进行 |
该反应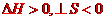 |
2.下列物质的化学用语正确的是 w.w.w.k.s.5.u.c.o.
①NH4H的电子式 ②硝基苯的结构简式:
②硝基苯的结构简式: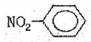
③葡萄糖的实验式:CH2 ④甲烷分子的比例模型: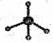
⑤Fe2+的离子结构: ⑥sp2杂化轨道模型:
⑥sp2杂化轨道模型:
⑦原子核内有10个中子的氧原子: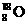
A.②③⑥⑦ B.①③⑤⑥
C.③⑥⑦ D.①②③④⑤⑥⑦
1.每年的6月5日是“世界环境日”,今年世界环境日主题是“促进低碳经济”,来自全球192个国家的谈判代表于2009年12月7-18日聚焦丹麦首都哥本哈根,召开《联合国气候变化框架公约》第15次缔约方会议,商讨2012年至2020年的全球减排协议。下列行为中不符合“促进低碳经济”宗旨的是
A.发展水电,开发新能源,如核能、太阳能、风能等,减少对矿物能源的依赖;
B.限制化学发展,关停化工企业,消除污染源头:
C.推广煤的干馏、气化、液化技术,提供清洁、高效燃料和基础化工原料,挖掘使用价值:
D.推广利用微生物发酵技术,将植物桔杆、动物粪便等制成沼气以替代液化石油气;
24.(16分)
 金属钛被称为铁和铝之后掘起的“第三金属”,常见化合价为+4,0,它是空间技术、航海、化工、医疗上不可缺少的材料,为了提高资源的利用率,减少环境污染,可将氯碱厂、炼钛厂和甲醇厂组成产业链,其关系如下图所示。
金属钛被称为铁和铝之后掘起的“第三金属”,常见化合价为+4,0,它是空间技术、航海、化工、医疗上不可缺少的材料,为了提高资源的利用率,减少环境污染,可将氯碱厂、炼钛厂和甲醇厂组成产业链,其关系如下图所示。
请回答下列问题:
 (1)钛铁矿经氧化法得到四氯化钛的化学反应为:
(1)钛铁矿经氧化法得到四氯化钛的化学反应为:
2FeTiO3 + 6C + 7Cl2 ==== 2FeCl3 + 2TiCl4 + 6CO,该反应中还原剂是____________,每生成1mol TiCl4 的过程中转移电子____________mol。
(2)TiCl4暴露在潮湿空气中冒白烟,白烟主要为白色的二氧化钛的水合物H2TiO3,试写出该反应的化学方程式_______________________________________________
(3)已知 ① Mg(s) + Cl2 (g)==== MgCl2(s) ΔH= -641 KJ/mol
② Ti(s) + 2Cl2 (g)==== TiCl4(l) ΔH= -770 KJ/mol
则Mg与TiCl4反应的热化学方程式为__________________________________________
该反应在氩气中进行的理由是________________________________________________
(4)氯碱厂电解饱和食盐水的离子方程式为________________________________________
将铝片和镁片用导线相连插入氢氧化钠稀溶液中构成原电池,写出负极的电极反应式
_____________________________________________________________________
(5)在上述产业链中,合成96t甲醇理论上需额外补充H2______________t(不考虑生产过程中物质的任何损失)
天津一中2010届高三上学期第三次月考
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com