
题目列表(包括答案和解析)
19. (12分)
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
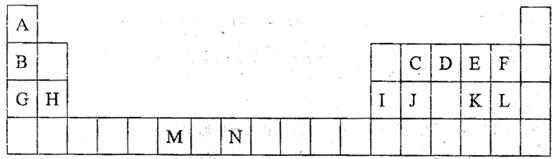
试回答下列问题:
(1)请写出元素N的基态原子电予排布式 。
(2)D的氢化物的分子构型为 ,该氢化物易溶于水的原因
(3)D和E的第一电离能的大小: > (用元素符号表示)
 (4)由A、C、D形成的ACD分子中,含有 个
(4)由A、C、D形成的ACD分子中,含有 个 键, 个
键, 个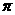 键。
键。
(5)元素M的化互为(MO2C12)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有 (填元素符号),其中一种金属的晶胞结构如右图所示,该晶胞中含有金属原子的数目为 。
②MO2C12常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2C12是
(填“极性”或“非极性”)分子。
③在a.苯、b.CH3OH、C.HCHO;d.CS2、e.CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有 (填序号),CS2分子的空间构型是: 。
18.(12分)
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
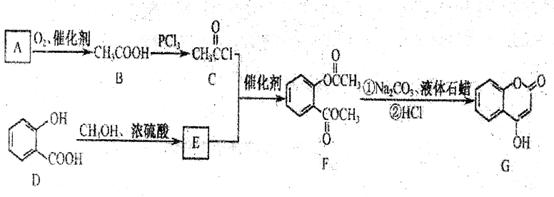
(1)A与银氨溶液反应有银镜生成,则A的结构简式是
(2)B→C的反应类型是 。
(3)写出两种满足下列条件的E的同分异构体的结构简式
①苯环上的一取代产物只有两种:②能发生银镜反应;③能与FeCl3溶液发生显色反应。
(4)写出下和过量NaOH溶液共热时反应的化学方程式:
(5)下列关于G的说法正确的是
a.能与溴的四氯化碳溶液反应 b.能与金属钠反应
c.1 molG最多能和3mol氢气反应 d.分子式是C9H6O3,
(6)请设计合理的方案以苯酚和乙醇为原料合成乙酸苯酯(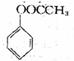 )用合成路线流程图表示,并注明反应条件)。提示:
)用合成路线流程图表示,并注明反应条件)。提示:
①合成过程中无机试剂任选;②合成反应流程图表示方法示例如下:
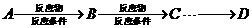
17. (10分)
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
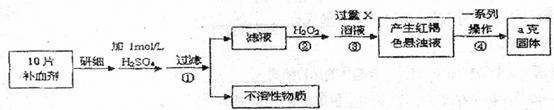
请回答下列问题:
(1)步骤②加入过量H2O2的目的:
(2)步骤③中反应的离子方程式
(3)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(4)若实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(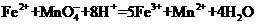 )
)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需
②上述实验中的KMnO4溶液需要酸化,用于酸他的酸是 。
a. 稀硝酸 b.稀硫酸 c.稀盐酸d.浓硝酸
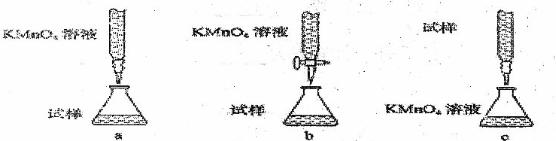
③某同学设计的下列滴定方式中,最合理的是 (夹持部分略起)(填字母序号)
16.(17分)
(I)二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制各二甲醚和甲醇的工业流程如下:
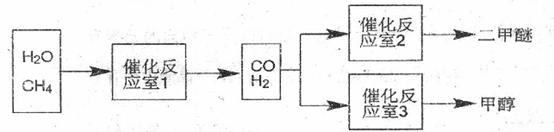
请填空:
(1)在一定条件下,反应室l中发生反应:
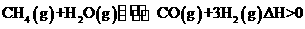 在其它条件不变的情况下降低温度,逆反应速率将
(填“增大”、“减小”或“不变”)。将1.0mLCH4和2.0molH2O通入反应室1(假设容积为100L,10min末有0.lmolCO生成,则10min内反应的平均速率
在其它条件不变的情况下降低温度,逆反应速率将
(填“增大”、“减小”或“不变”)。将1.0mLCH4和2.0molH2O通入反应室1(假设容积为100L,10min末有0.lmolCO生成,则10min内反应的平均速率
V(H2)= 。
(2)在一定条下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为 。
(3)在压强为0.1MPa条件下.反应室3(容积为VL)amolCO与2amolH2在催化剂作用下反应生成甲醇: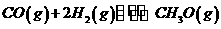 ,CO的平衡转化率与温度、压强的关系如右图所示,则:
,CO的平衡转化率与温度、压强的关系如右图所示,则:
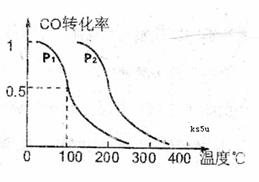 ①P1 P2,正反应的
①P1 P2,正反应的 =0,(填“<” 、“>”或“=”).
=0,(填“<” 、“>”或“=”).
②在其它条件不变的情况下,反应室3再增加amolCO与2amolH2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”。下同)。平衡常数 。
③在Pl压强下,100℃时,
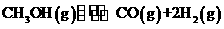 ,反应的平衡常数为
(用含a、V的代数式表示)。
,反应的平衡常数为
(用含a、V的代数式表示)。
(II)(4)在25℃下,向浓度均为0.1 mol ·L-1的mgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 。已知25℃时Ksp[Mg(OH)2]=1.8×10-11n,Ksp[Cu(OH)2]=2.2×10-20。
(5)在25℃下,将a mol ·L-1的氨水与0.01 mol ·L-1的盐酸等体积混合,反应平衡时溶液中 。则溶液显
性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
。则溶液显
性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
15. (10分)
下列图1中B是一种常见的无色无味的液体。C是一种有磁性的化合物,E是一种无色无味的有毒气体。根据下列图l、图2,回答下列问题:
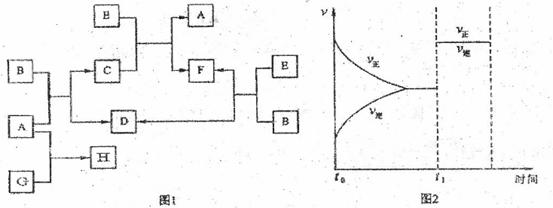
(1)写出生成C的化学方程式并标出电子转移方向和数目: 。
(2)E和N2是等电子体,请写出E的可能电子式: 。
(3)在101kPa和150℃时,可逆反应E(g)+B(g) F(g)+D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
。
F(g)+D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
。
A.升高温度 B.增大压强
C.加入催化剂 D.增大一倍原平衡混合气体的量
(4)若G是一种淡黄色固体单质,16gG和足量的A反应放出的热量为Q kJ(Q>O),写出这个反应的热化学方程式: 。
若G是一种气态单质,H的水溶液可以和有机物I反应使溶液呈紫色,请写出I的结构简式: ;H的水溶液呈酸性,请用离子方程式表示呈酸性的原因:
。
14.(10分)
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定;加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:
 (未配平)
(未配平)
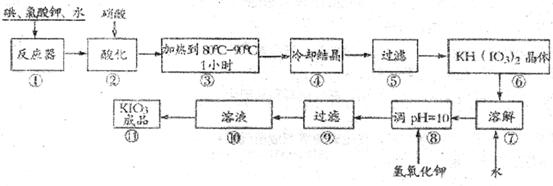
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式: ;
(2)步骤②中.用稀酸酸化的作用是 ;
在稀硝酸和稀盐酸中不能选用的酸是: ,其原因是
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 .
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
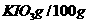 水 水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
13.(10分)
用含少量铁的氧化铜制取氯化铜晶体(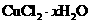 )。有如下操作:
)。有如下操作:
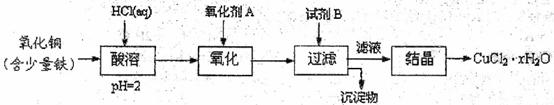
已知:在pH为4-5时,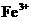 几乎完全水解而沉淀,而此时
几乎完全水解而沉淀,而此时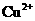 却几乎不水解。
却几乎不水解。
(1)氧化剂A可选用 (填编号,下同)
①C12 ②KMnO4 ③HNO3 ④H2O2
(2)要得到较纯的产品,试剂B可选用
①NaOH ②FeO ③CuO ④Cu2(OH)2CO3
(3)试剂B的作用是
①提高溶液的pH ②降低溶液的pH ③使Fe3+完全沉淀 ④使Cu2+完全沉淀
(4)从滤液经过结晶得到氯化铜晶体的方法是 (按实验先后顺序选填编号)
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
(5)为了测定制得的氯化铜晶体(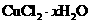 )中x值,某兴趣小组设计了两种实验方案:
)中x值,某兴趣小组设计了两种实验方案:
方案一:称取mg晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为mg。
方案二:称取m g晶体、加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止、冷却、称量所得固体的质量为n g。
试评价上述两种实验方案,其中正确的方案是 ,据此计算得x=
(用含m、n的代数式表示)。
12.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。则下列有关说法中正确的是
A.X的氢化物溶于水显酸性
B.Y的氧化物是离子化合物
C.Z的氧化物的水化物一定是强酸
D.X和Z的最高价氧化物对应的水化物都是弱酸
非选择题部分(共78分)
11.已知NO2和N2O4可以相互转化: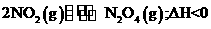 。现将一定量NO2
。现将一定量NO2
和N2O4的混合气体通入容积为1L的恒温密闭容器中,反应物和生成物浓度随时间的变化关系如右图所示。下列有关说法中错误的是

A.图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d
C.若要达到与d相同的状态,在25min时还能采取的措施是适当缩小容器体积
D.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4
10.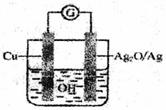 普通水泥在固化过程中自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O十2Ag下列有关说法正确的是
普通水泥在固化过程中自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O十2Ag下列有关说法正确的是
A.工业上以黏土、石灰石和石英为主要原料来制造普通水
泥
B.负极的电极反应式为: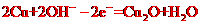
C.测量原理示意图中,电流方向从Cu经过导线流向Ag2O
D.电池工作时,溶液中 向正极移动
向正极移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com