
题目列表(包括答案和解析)
1.22种非金属元素,有6种是稀有气体;除H外均处于周期表右上方;除第一周期外,每周期非金属元素数目=8-周期序数。
3.以结构为主线,以元素周期律为指导,联系类型、掌握递变。
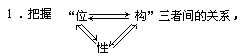
落实存在、性质、制备、用途四要点。
(1)从位置出发,以Cs为例。位置:第六周期,IA族。→结构特点:最外层只有一个电子,原子半径大。→比Na、K更活泼的金属元素,具强的金属性。→应隔绝空气保存;与水反应剧烈,可能发生爆炸;与氧气迅速反应,主要产物肯定不是Cs2O。
(2)从结构出发:已知某元素原子有六个电子层,最外层2个电子→最外层电子数少,电子层数多,应是活泼金属,金属性大于钙→与水剧烈反应;氢氧化物是可溶性强碱;碳酸盐、硫酸盐均不溶于水。
 (3)从性质出发:某单质能从水中置换出O2。→非金属性大于氧,应为最活泼的非金属元素F→在周期表的右上角,第二周期ⅦA族→可与绝大多数金属、非金属甚至某些稀有气体直接反应;化合价只有-1价;几乎无法用氧化剂将F-氧化成F2。
(3)从性质出发:某单质能从水中置换出O2。→非金属性大于氧,应为最活泼的非金属元素F→在周期表的右上角,第二周期ⅦA族→可与绝大多数金属、非金属甚至某些稀有气体直接反应;化合价只有-1价;几乎无法用氧化剂将F-氧化成F2。
分析:
归纳:
2.总结规律、串联比较,使知识系统化、网络化。
归纳思维过程:位置→最外层电子数→成键情况→实际价态→化学式
即:位置→结构→性质
30.(8分)为了度量水中有机物等还原性污染物的含量,通常把1 L水样与强氧化剂完全作用时消耗氧化剂的量,折算成以氧气为氧化剂时的质量(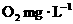 )来表示,称为该水样的化学耗氧量(COD).我国明文规定:
)来表示,称为该水样的化学耗氧量(COD).我国明文规定: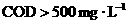 的污水不得直接排放.
的污水不得直接排放.
为测定某工业为水的COD,实验如下:量取废水样品20.00 mL,加入
 溶液10.00 mL和少量稀
溶液10.00 mL和少量稀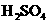 ,在一定条件下充分反应后,再用
,在一定条件下充分反应后,再用 的草酸钠(
的草酸钠(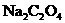 )溶液滴定过量的
)溶液滴定过量的 ,达到终点时消耗
,达到终点时消耗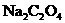 溶液11.00 mL.
溶液11.00 mL.
(1)写出在酸性介质中 (被还原为
(被还原为 )与
)与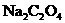 (被氧化为
(被氧化为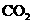 )反应的离子方程式________________.
)反应的离子方程式________________.
(2)计算该水样的COD,写出计算过程.
(3)如果每次取水样20.00 mL,加入等体积的 酸性
酸性 溶液,为简化计算,令滴定过量
溶液,为简化计算,令滴定过量 时,每消耗
时,每消耗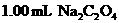 溶液,就相当于水样的COD为
溶液,就相当于水样的COD为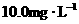 ,该
,该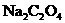 溶液的物质的量浓度应配制为_________.
溶液的物质的量浓度应配制为_________.
(4)若无需其他计算,只需通过实验测定下列两组方案中a与b的值,并直接根据a与b的比值来确定该工业废水可否直接排放.你认为其中适宜可行的方案是________(填写序号);并根据你的选择计算:当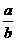 (填写取值范围)________时,该工业废水不能直接排放.
(填写取值范围)________时,该工业废水不能直接排放.
|
实验方案 |
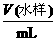 |
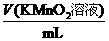 |
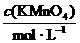 |
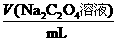 |
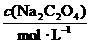 |
|
A |
a |
a |
0.100 |
b |
0.100 |
|
B |
a |
20.00 |
0.100 |
20.00 |
b |
29.(9分)把NaOH、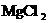 、
、 三种固体组成的混合物溶于足量水后有1.16 g白色沉淀,在所得的浊液中逐滴加入
三种固体组成的混合物溶于足量水后有1.16 g白色沉淀,在所得的浊液中逐滴加入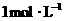 HCl溶液,加入HCl溶液的体积与生成沉淀
HCl溶液,加入HCl溶液的体积与生成沉淀
的质量关系如图.试回答:
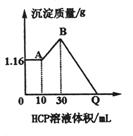
(1)A点的沉淀物的化学式为________________,B点的沉淀物的化学式为_________________.
(2)原混合物中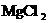 的质量是________g,
的质量是________g, 的质量是_________g,NaOH的质量是_________g.
的质量是_________g,NaOH的质量是_________g.
(3)Q点HCl溶液加入量是_________mL.
28.(7分)测定某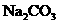 和
和 混合物的组成,可取两份各w g的试样分别溶于水.第一份用甲基橙为指示剂,用
混合物的组成,可取两份各w g的试样分别溶于水.第一份用甲基橙为指示剂,用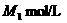 稀盐酸在不停摇动时滴定到终点,消耗该酸
稀盐酸在不停摇动时滴定到终点,消耗该酸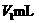 .第二份准确加入
.第二份准确加入 浓度为
浓度为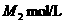 的NaOH溶液后,再加
的NaOH溶液后,再加 溶液至沉淀完全为止,然后滴入酚酞指示剂,再用
溶液至沉淀完全为止,然后滴入酚酞指示剂,再用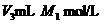 的盐酸滴定到终点.
的盐酸滴定到终点.
②若第二份试样换用甲基橙为指示剂,再用盐酸滴定至终点,其结果会是_______________________________________________,原因是________________________.
② 在原混合物中质量百分数的计算式为______________.
在原混合物中质量百分数的计算式为______________.
③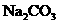 在原混合物中质量百分数的计算式为______________.
在原混合物中质量百分数的计算式为______________.
27.(8分)简答下列各题:
(1)在工厂里,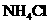 和
和 可作焊药,是何道理?
可作焊药,是何道理?
(2)在 溶液里通入
溶液里通入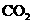 ,不会产生
,不会产生 沉淀,但加入氨水,则立即有
沉淀,但加入氨水,则立即有 沉淀产生.
沉淀产生.
(3)试说明工业用 制无水
制无水 时,必须将
时,必须将 在干燥的HCl气流中加热脱水是何道理?
在干燥的HCl气流中加热脱水是何道理?
(4)土壤的碱性主要是由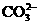 水解引起的,用石膏能否改良碱性土壤?为什么?
水解引起的,用石膏能否改良碱性土壤?为什么?
(5)在农业上,草木灰不能跟铵态氮肥、普钙等混用,试阐述理由.农田在长期施用硫铵后,又要施用一些消石灰,这是为何?
26.(10分)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.
若25℃时有

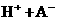 ,则
,则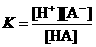
式中:K为电离平衡常数,只与温度有关,[ ]为各微粒的平衡浓度.下表是几种常见弱酸的电离平衡常数(25℃)
|
酸 |
电离方程式 |
电离平衡常数K |
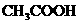 |
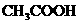   |
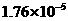 |
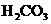 |
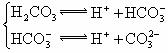 |
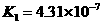 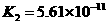 |
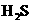 |
 |
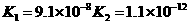 |
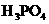 |
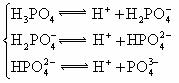 |
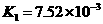 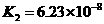 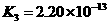 |
回答下列各问:
(1)K只与温度有关,当温度升高时,K值________(填“增大”、“减小”、“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?
________________________________________________________________________.
(3)若把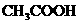 、
、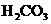 、
、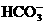 、
、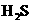 、
、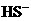 、
、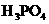 、
、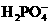 、
、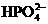 都看作是酸,其中酸性最强的是_________,最弱的是________.
都看作是酸,其中酸性最强的是_________,最弱的是________.
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数.对于同一种多元弱酸的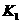 、
、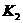 、
、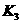 之间存在着数量上的规律,此规律是________________,产生此规律的原因是_________________________.
之间存在着数量上的规律,此规律是________________,产生此规律的原因是_________________________.
(5)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,C
mol/L的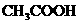 的电离数为a .试表示该温度下醋酸的电离平衡常数
的电离数为a .试表示该温度下醋酸的电离平衡常数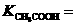 _________.
_________.
25.(10分)测定海水中溶解氧的步骤如下:
①水样的固定:取a mL海水样迅速加入固定剂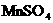 溶液和碱性KI溶液(含KOH),立即塞好塞子,并振荡均匀,使之充分反应.
溶液和碱性KI溶液(含KOH),立即塞好塞子,并振荡均匀,使之充分反应.
②酸化:开塞后迅速加适量1∶1硫酸,再迅速塞好塞子,反复振荡至沉淀完全溶解.
③滴定:向溶液中加入1
mL 0.5%淀粉溶液,再用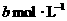 的
的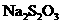 标准溶液滴定至溶液刚好褪色.
标准溶液滴定至溶液刚好褪色.
有关的离子反应如下:
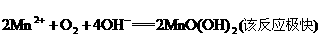
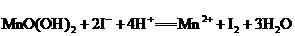
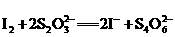
请回答下列问题:
(1)在进行①、②操作时,要注意“迅速”,如果操作缓慢,会使测定结果________(填偏高、偏低或无影响),原因是___________________________.
(2)滴定前,用蒸馏水洗净滴定管即加入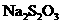 标准溶液,会使测定结果_______(填偏高、偏低或无影响),原因是__________________________.
标准溶液,会使测定结果_______(填偏高、偏低或无影响),原因是__________________________.
(3)滴定前,未排除滴定管中的气泡,在滴定过程中气泡排除,会使测定结果_______(填偏高、偏低或无影响),原因是__________________________.
(4)滴定时消耗了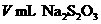 标准溶液,则水中溶解
标准溶液,则水中溶解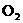 (g/L)的量的计算式为_________.
(g/L)的量的计算式为_________.
24.A、B两种物质都是由氢、氮、氧、钠四种元素中的任意三种元素所组成,它们的水溶液分别呈酸性或碱性,在同温下,A溶液的pH大于相同浓度的B溶液的pH(溶液浓度不大于 ),请找出A和B可能有的两种组合,并且要求当这两种组合中的B溶液pH相同时,第一种组合的B溶液中的水的电离度小于第二种组合的B溶液中水的电离度.
),请找出A和B可能有的两种组合,并且要求当这两种组合中的B溶液pH相同时,第一种组合的B溶液中的水的电离度小于第二种组合的B溶液中水的电离度.
(1)写出可能有的两种组合中,A和B的化学式:
第一种组合:A是_________,B是_________;
第二种组合:A是_________,B是_________.
(2)说明pH相等时,第一种组合B溶液中的电离度比第二种混合的B溶液中水的电离度小的原因:________________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com