
题目列表(包括答案和解析)
8.36216 N2 Si3N4 小于 减小 6
7.答案:(1)C4H10O 羟基、碳碳双健 CH2=CHCH2CH2OH
(2)①加成反应 ②取成反应
(3)abc
(4)C: D和E:
D和E: (5)
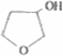
(5) +NaOH
+NaOH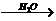
 +NaBr
或
+NaBr
或 +H2O
+H2O
 +HBr
(6)CH2=CHOCH2CH3、CH2=C(CH3)OCH3、CH2=CHCH2OCH3、CH3CH=CHOCH3
+HBr
(6)CH2=CHOCH2CH3、CH2=C(CH3)OCH3、CH2=CHCH2OCH3、CH3CH=CHOCH3
10.
⑴ 。
⑵
9. Ⅰ:
⑴ mL, mL。
⑵ 。
⑶ 。
⑷ 。
⑸
① 。
② 、 、 。
⑹ mol。
Ⅱ:
( l )___________
(2)____________ ,_________ _________ ____。
(3)
②_____________________________________________________________
③_____________________________________________________________
8. ⑴

⑵ , ;
⑶K= ;
⑷ΔH 零
⑸ ;
⑹v(N2)= mol/(L•min)。
7. (Ⅰ)(1) 。 。 。
(2)① ,② 。
(3) 。
(4)C 、D 、E 。
(5) 。
(6) 。
Ⅱ:(1) ;
(2) ;
; ;
④ ; ⑥ 。
10.科学家一直致力研究常温、常压下“人工围氮”的新方法。曾有实验报道:在常温、常压、学照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105Pa、反应时间3 h):
|
T/K |
303 |
313 |
323 |
353 |
|
NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
2.0 |
相应的热化学方程式如下:
N2(g)+3H2O(1)=2NH3(g)+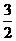 O2(g) ΔH=+765.2kJ·mol-1
O2(g) ΔH=+765.2kJ·mol-1
回答下列问题:
⑴与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提
 高其反应速率且增大NH3生成量的建议:
。
高其反应速率且增大NH3生成量的建议:
。
⑵工业合成氨的反应为N2(g)+3H2(g) ? 2NH3(g)。设在容积为2.0L的密
闭容器中充入0.60mol N2(g)和1.60 mol H2(g),.反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为 。计算
。计算
①  该条件下N2的平衡转化率;
该条件下N2的平衡转化率;
② 该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数。
2009届高三一模模拟试题
班级 姓名
9. Ⅰ:明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化 铝和少量氧化铁杂质。具体实验步骤如下图所示:

根据上述图示,完成下列天空:
⑴明矾石焙烧后用稀氨水浸出。配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每 升含有250.28g氨) mL,用规格为 mL量筒量取。
⑵氨水浸出后得到固液混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。检验NH4+的方法是 。
⑶写出沉淀物中所有物质的化学式 。
⑷滤液I的成分是水和 。
⑸为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量 溶液,产生白色沉淀。
② 、 、 (依次填写实验操作名称)。
③冷却、称重。
⑹若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为: mol(用含m、n的代数式表示)。
Ⅱ:某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等, 取该溶液进行如下实验:
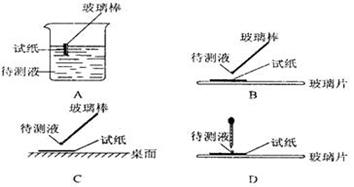
① 用蓝色石蕊试纸检测该溶液,试纸显红色;
② 取溶液少许,加人铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕 色;
③ 取溶液少许,加人氨水有白色沉淀生成,继续加人过量氨水,沉淀不消失;
④ 取溶液少许,滴人氯化钡溶液产生白色沉淀;
 ⑤ 取实验 ④ 后的澄清溶液,滴人硝酸银溶液产生白色沉淀,再加人过量的稀硝酸,沉淀不消失。
⑤ 取实验 ④ 后的澄清溶液,滴人硝酸银溶液产生白色沉淀,再加人过量的稀硝酸,沉淀不消失。
请回答下列问题:
( l )在实验 ① 中,下图所示的操作中正确的是___________(填代号)
(2)根据上述实验判断原溶液中肯定存在的离子是____________ ,
肯定不存在的离子是__________________ ____。
(3)写出与②③两个实验有关的离子方程式:
②_____________________________________________________________
③_____________________________________________________________
8.氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:

⑴配平上述反应的化学方程式(将化学计量数填在方框内)
⑵该反应中的氧化剂是 ,其还原产物是 ;
⑶该反应的平衡常数表达式为K= ;
⑷若知上述反应为放热反应,则其反应热为ΔH 零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”)
⑸若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
⑹若已知CO生成速率为v(CO)=18mol/(L•min)则N2的消耗速率为v(N2)= mol/(L•min)。
7.Ⅰ:碱存在下,卤代烃与醇反应生成醚(R-O-R’):
R-X+R‘OH R-O-R’+HX化合物A经下列四步反应可得到常用溶剂四氢 呋喃,反应框图如下:
R-O-R’+HX化合物A经下列四步反应可得到常用溶剂四氢 呋喃,反应框图如下:

请回答下列问题:
(1)1mol A和1mol H2在一定条件下恰好反应,生成饱和一元醇Y,Y中碳元素的质量分数约为65%,则Y的分子式为 。A分子中所含官能团的名称是 。
A的结构简式为 。
(2)第①②步反应类型分别为① ,② 。
(3)化合物B具有的化学性质(填写字母代号)是 。
a.可发生氧化反应 b.强酸或强碱条件下均可发生消去反应
c.可发生酯化反应 d.催化条件下可发生加聚反应
(4)写出C、D和E的结构简式:
C 、D 、E 。
(5)写出化合物C与NaOH水溶液反应的化学方程式: 。
(6)写出四氢呋喃链状醚类的所有同分异构体的结构简式: 。
Ⅱ:某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为 ;
(2)A中碳原子是否都处于同一平面? (填“是”或“不是”);
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。
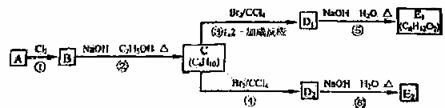
反应②的化学方程式为 ;
C 的化学名称是 ;E2的结构简式是 ;
④、⑥的反应类型依次是 ; 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com