
题目列表(包括答案和解析)
1.电解法
①电解水溶液:如2NaCl+2H2O 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
②电解熔融物:如2KHF2 F2↑+H2↑+2KF
F2↑+H2↑+2KF
(1)常见的含氧酸
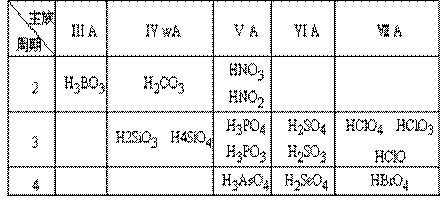
(2)酸性强弱递变规律
同主族由上至下酸性逐渐减弱;同周期由左到右酸性逐渐增强;同种元素中,高价态酸的酸性一般大于低价态酸的酸性。
(3)氧化性酸与还原性酸
常见的强氧化性酸有:HNO3、浓H2SO4、HClO等。
常见的还原性酸有:H2SO3、H3PO3等。
HNO2既有氧化性,又有还原性,但以氧化性为主。
(4)某些酸的特殊性质
浓H2SO4:吸水性→做干燥剂;脱水性→使晶体脱结晶水,使有机物碳化。
HClO:漂白作用。漂白原理与Na2O2同,是利用强氧化性破坏有色物质。
H2SO3:漂白作用。与某些有色物质结合生成不稳定的无色物质,加热后恢复原色。
HF:与SiO2反应。SiO2+4HF→SiF4↑+2H2O
注意:酸的氧化性与氧化性酸是两个不同的概念。酸的氧化性就是指酸中H+结合电子的性质,凡酸皆有此性质。而氧化性酸是指含氧酸的中心元素结合电子的性质。
3.水溶液酸性还原性:非金属元素的非金属性越强,其气态氢化物的还原性越弱;非金属元素的非金属性越弱,其气态氢化物的还原性越强。
2.水溶液酸碱性:ⅥA、ⅦA族元素的气态氢化物的水溶液一般为挥发性酸(HCl、HBr、HI为强酸,其余为弱酸);NH3水溶液碱性,其余不溶,可视为中性。
1.物理性质:一般都是无色气体;除CH4、SiH4外,均为极性分子,都有刺激性气味;HX、NH3易溶于水,H2S可溶,其余一般不溶。
1.氧化性
(1)与氢气反应
总结:
结论:非金属元素的非金属性越强,其非金属单质的氧化性就越强,就越易与氢气反应;生成的气态氢化物也就越稳定。
(2)与金属反应
2Fe+3Cl2 2FeCl3剧烈反应,大量棕褐色的烟。
2FeCl3剧烈反应,大量棕褐色的烟。
Cu+Cl2 CuCl2剧烈燃烧,生成棕黄色的烟。加少量水,溶液变绿色;再加水,溶液变蓝绿色。
CuCl2剧烈燃烧,生成棕黄色的烟。加少量水,溶液变绿色;再加水,溶液变蓝绿色。
6Fe+4O2
 2Fe3O4剧烈燃烧,火星四射,生成黑色固体。
2Fe3O4剧烈燃烧,火星四射,生成黑色固体。
2Cu+O2  2CuO加热变黑。
2CuO加热变黑。
Fe+S  FeS剧烈反应,生成黑色固体。
FeS剧烈反应,生成黑色固体。
2Cu+S  Cu2S铜在硫蒸气中燃烧,有红光。
Cu2S铜在硫蒸气中燃烧,有红光。
结论:非金属单质与变价金属反应,若非金属单质的氧化性较强(如O2、Cl2、Br2等),则金属被氧化成高价态化合物;若非金属单质的氧化性较弱(如I2、S等),则金属被氧化成低价态化合物。
(3)非金属单质间的反应
通常,非金属单质可以与O2或X2反应,生成相应的氧化物或卤化物。O2做氧化剂,除X2外的非金属单质均可被直接氧化;X2做氧化剂,许多非金属单质也可被氧化,较熟悉情况为H2、P等。
原则:非金属性强的氧化非金属性弱的。
(4)非金属间的置换
即:元素同周期,右边的置换左边的;元素同主族;上面的置换下面的。
写化学方程式:
①Cl2+Br-(I-)或Br2+I-;O2+H2S;C+SiO2。
②F2+H2O;Cl2+H2S;CH4+O2(不完全燃烧)。
③O2+HI;Br2+H2S;I2+H2S。
3.溶解性:除F2与水发生置换反应,Cl2、Br2在水中发生自身氧化还原反应(部分)外,可以说非金属单质均难溶于水。
2.晶体类型:原子晶体B、C、Si;分子晶体:除B、C、Si外的其它(常见)非金属单质。
1.常温下状态:气态H2、N2、O2、F2、Cl2(稀有气体除外);液态Br2;其余为固态。
2.除H、He、B外,最外层电子数≥4;且原子半径比同周期的金属元素小。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com