
题目列表(包括答案和解析)
5.5.不具有放射性的同位素称之为稳定同位素,稳定同位素分析法在科学研究中获得了广泛
的应用。如2H、13C、15N、18O、34S等常用作环境分析指示物。下列有关说法正确的是
A.34S原子核内中子数为16 B.16O与 18O互称同位素
C.13C和15N原子核内的质子数相差2 D.2H+结合OH-的能力比1H+更强
4.北京奥运会金牌为金镶玉。某化学兴趣小组对金牌中金属的成分提出猜想:甲认为该金
属是由纯金制成;乙认为该金属是由金银合金制成;丙认为该金属是由黄铜(铜锌合金)
制成。为了验证他们的猜想,取制造这种金牌的材质粉末少量进行实验,只需加入下面
一种试剂即可证明甲、乙、丙猜想的正误,该试剂应是
A.硫酸铜溶液 B.盐酸 C.稀硝酸 D.硝酸银溶液
3.化学概念在逻辑上存在如下关系:
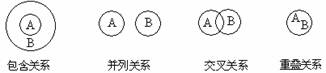
对下列概念的说法正确的是
A.化合物与电解质属于重叠关系 B.化合物与碱性氧化物属于交叉关系
C.溶液与胶体属于并列关系 D.氧化还原反应与放热反应属于包含关系
2.下列关于有机物的说法中,不正确的是
A.液化石油气和天然气的主要成分都是甲烷
B.苯、乙醇和乙酸都能发生取代反应
C.油脂在碱的催化作用下可发生水解,工业上利用该反应生产肥皂
D.用新制的Cu(OH)2可检验尿液中的葡萄糖
1.化学与环境、工农业生产等密切相关,下列叙述正确的是网
A.光化学烟雾与大量排放碳氢化合物和氮氧化合物有关
B.将草木灰和硫酸铵混合施用,肥效更高
C.棉花、蚕丝和锦纶的主要成分都是纤维素
D.为了防止中秋月饼等富脂食品氧化变质,延长保质期,可在包装袋中放入生石灰
2.考生请将第I卷选择题的正确选项涂写在答题卡上或填写在II卷的答题栏中,考试结束后,只收第II卷和答题卡。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23
Mg-24 Al-27 Cl-35.5 Fe-56 Mn-55
第I卷(选择题,共48分)
1~16小题,每小题3分,共48分。每小题只有一个选项符合题意
1.本试卷包括第I卷(选择题)和第II卷(非选择题)两部分,共100分。考试时间90分钟。
33.(16分)
从甲苯出发,按下面流程可以合成苯甲酸苯甲酯和水杨酸。
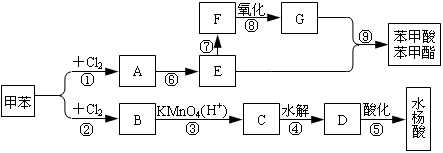
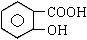
已知水杨酸的结构简式为 ,请回答:
(1)写出下列反应的条件:① 、⑦ ;
(2)C、F的结构简式分别为:C 、F ;
(3)写出反应⑥、⑨的化学方程式:
⑥ ⑨ ;
(4)③、④两步反应能否互换,为什么? 。
(5)同时符合下列条件的水杨酸的同分异构体共有 种。
①苯环上有3个取代基
②能发生银镜反应
③与足量NaOH溶液反应可消耗2molNaOH
32.(16分)
某溶液中可能含有SO32-、SO42-、 HCO3- 三种离子中的两种或三种。为探究其组成,小明取出两份相同的样品溶液于试管中,向一份中加入过量的盐酸,产生无色气泡;向另一份中滴加过量的氯化钡溶液,产生白色沉淀。请设计合理实验,做进一步的探究,对小明的实验给出结论。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、集气瓶、铁架台、漏斗、滤纸、酒精灯、带单孔胶塞的导管;lmol/L硫酸;2mol/L盐酸;2mol/L硝酸、;lmol/L氯化钡、澄清石灰水、品红溶液、蒸馏水。
完成下列探究过程:
(1)提出假设:
假设l:溶液中存在SO32-、SO42- 假设2: ;
假设3: ;假设4:溶液中存在SO32-、SO42-、 HCO3-
(2)基于假设4 , 设计出实验方案,将实验操作、预期的实验现象和结论填在下表中。
[提示] I、在答题卡上按照下表的方式作答,注意前后内容的对应。
Ⅱ、注意文字简洁,超出答题卡空间视为无效。
III 、可不填满,也可增加步骤。
|
步骤编号 |
实验操作 |
预期现象和结论 |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
|
…… |
…… |
…… |
31.(16分)
现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高。
⑴ 已知:1 mol N2(g)与适量H2(g)完全反应,生成NH3(g),放出92.2 kJ热量,写出反应的热化学方程式: 。
⑵若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1 K2(填“>” “=” 或 “<” )。
⑶在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2 及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为 ,用氮气表示的反应速率为: 。若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议:
(任意写一条)。
⑷在上述相同条件下,若起始时加入4 mol NH3、2 mol H2及固体催化剂,反应达到平衡时NH3的体积分数比(3)中 (填“大”、“小”或“相等”)。
⑸氨被氧化生成一氧化氮的化学方程式为: 。
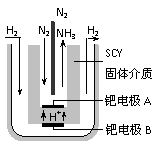 ⑹随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如右图)。
⑹随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如右图)。
请回答:在电解法合成氨的电解池中 (填“能”或“不能”) 用水作电解质溶液的溶剂,原因是 。
钯电极A是电解池的 极(填“阳”或“阴”),该极上的电极反应式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com