
题目列表(包括答案和解析)
13.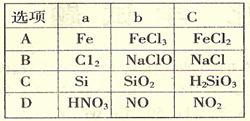 课外学习小组为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使红色石蕊试纸变蓝。由该实验能够得到的正确结论是
课外学习小组为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使红色石蕊试纸变蓝。由该实验能够得到的正确结论是
A.原溶液中一定含有SO42-离子B.原溶液中一定含有NH4+离子
C.原溶液中一定含有CI-离子D.原溶液中一定含有Fe3+离子
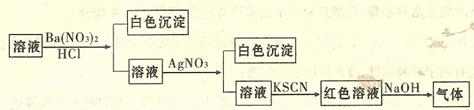
12.下列各物质中,不 是按
是按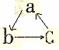 (“→”表示一步完成)关系相互转化的是:
(“→”表示一步完成)关系相互转化的是:
11.反应2A(g)+B(g)
 2C(g);△H=akJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,Y的物质的量n(Y)与反应时间(t)的关系如下图所示,下列判断正确的是
2C(g);△H=akJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,Y的物质的量n(Y)与反应时间(t)的关系如下图所示,下列判断正确的是
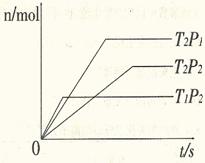 A.Y可能是A或B,a>0
A.Y可能是A或B,a>0
B.Y可能是A或B,a<0
C.Y一定是C,a>0
D.Y一定是C,a<0
10.下列化学实验事实及其解释都正确的是:
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.某气体能使湿润的红色石恋试纸变蓝,该气体水溶液一定显碱性
C.加入AgN03溶液,生成白色沉淀,再加入稀盐酸沉淀不溶解,可确定有CI-存在
D.用量筒取5.00mL1.00mol·L-1盐酸于50mL容量瓶中,加水稀释至刻度,可配制0.100mol·L-1盐酸
9.下列各溶液中,微粒的物质的量浓度关系正确的是:
A.常温下,在pH=8的NaA溶液中:c(Na+)-c(A-)=9.9×10-7mol/L
B.由10mLO.lmol/L的CH3COOH溶液与10mL0.lmoL/L的NaOH溶液混合,浓度大小的顺序
为:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
c.室温下,由pH=l的CH3COOH溶液与pH=13的NaOH溶液等体积混合,浓度大小的顺序为:
c(Na+)>c(CH3COO-)>c(OH-)>(H+)
D.常温下,0.lmol/LpH=8的NaHB溶液中: c(HB-)>c(B2-)>c(H2B)
c(HB-)>c(B2-)>c(H2B)
8.下列对相关化学反应的离子方程式书写的评价正确的是:
|
编 |
化学反应 |
离子方程式 |
评价 |
|
号 |
|||
|
A |
过 氧化销与水反应 氧化销与水反应 |
2022-+2H20=40H-+Oz↑ |
正确 |
|
B |
漂白粉溶液中通入过量SO2 |
ClO-+H20+SOz==HS03-+HCIO |
正确 |
|
C |
醋酸铵溶液中加入盐酸 |
CH3COONH4+H+=CH3COOH+NH4+ |
醋酸铵错误,不应写成化学式 |
|
D |
NaHC03溶液呈碱性 |
HC03-+、H20  H2C03+OH- H2C03+OH- |
错误,应放出COz |
7.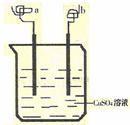 .如右图所示,a、b两电极材料分别为铁丝和铜丝。则以下说法不正确的是 ( )
.如右图所示,a、b两电极材料分别为铁丝和铜丝。则以下说法不正确的是 ( )
A.该装置可以构成原电池,也可构成电解池
B.a极可能发生反应:Cu+2e-==Cu
C.b电极质量可能增加
D.该过程可能有大量气体产生
6.从宏观方面看物质由元素组成,从微观方面看物质由粒子构成。下列说法不正确的是 ( )
A.质子数等于电子数的某微粒,可能是一种分子或一种离子
B.只由一种分子组成的物质一定为纯净物
C..3517Cl与3717Cl互为同位素
D.46gNO2和46gN204含有的原子数相等
5.下列各组离子一定能大量共存的是: ( )
A.无色溶液:Ca2+、H+、C1-、HSO3-
B.能与金属铝反应放出氢气的溶液中:K、N03-、C1-、Fe3+
C.KW/c(H+)==0.1mol/L的溶液:Na+、K+、CO32-、NO3-
D.pH=l的无色溶Na+、Cu2+、CO32-、NO3-
4.下列说法正确的是: ( )
A.离子化合物中一定只存在离子键
B.溶液呈电中性,而有的胶体带电荷
C.最外层电子数为2的元素一定位于第IIA族
D.置换反应都属于氧化还原反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com