
题目列表(包括答案和解析)
2.在含有Cu(NO3)2.Zn(NO3)2 Fe(NO3)3.AgNO3各0.1mol的混合溶液中加入0.1mol Fe粉,充分搅拌后铁溶解,溶液中不存在Fe3+离子,同时析出0.1molAg。则下列结论中不正确的是 ( )
A.溶液中Cu2+与Fe2+的物质的量之比为1:2
B.氧化性:Ag+>Cu2+>Fe3+>Zn2+
C.Fe3+的氧化性大于Cu2+
D.1molFe可还原2molFe3+
1.下列离子方程式正确的是 ( )
A.过量的NaHSO4和Ba(OH)2溶液反应:H+ + SO42- + Ba2+ + OH- == BaSO4↓ +2H2O
B.NH4HCO3和过量NaOH溶液相混合:HCO3- + OH- == CO32- + H2O
C.NaHSO4溶液中滴加NaHCO3溶液:H+ + HCO3- == H2O + CO2↑
D.用氨水吸收少量的SO2:NH3 + H2O + SO2 == NH4+ + HSO3-
23.过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ.测定过氧化氢的含量
请填写下列空白:
(1)移取10.00 mL密度为r g/mL的过氧化氢溶液至250 mL____________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
□MnO4- +□H2O2+□H+ □Mn2++□H2O+□_____
□Mn2++□H2O+□_____
(3)滴定时,将高锰酸钾标准溶液注入_______(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是__________________________________________________________
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为_____________________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学举小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
|
实 验 内 容 |
实 验 方 法 |
实 验 现 象 |
|
验证氧化性 |
|
|
|
验证不稳定性 |
|
|
|
22.(12分)A-J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。请回答下列问题:
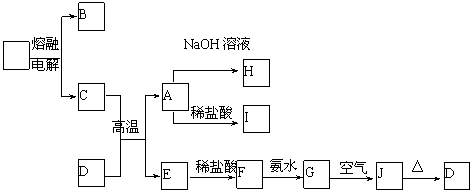
(1)A的化学式为
 (2)H溶液中通入过量的CO2,其反应的离子方程式是
(2)H溶液中通入过量的CO2,其反应的离子方程式是
G→J的化学方程式为
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因
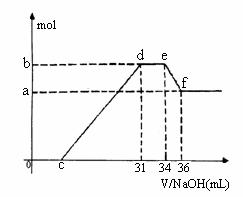
(4)现有一定量C、E混合物与稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4mol /L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。坐标图c点溶液中溶质除C和E的硝酸盐外,还含有的溶质是__________ 其对应物质的量为
21.已知A、B、C、D、E为五种短周期不同主族的元素,其原子序数依次递增。A、E两种原子最外层电子数之和是B原子最外层电子数的2倍;C、E两种原子最外层电子数之和是D原子最外层电子数的2倍。A、E形成的化合物分子甲中电子总数为18,D是地壳中含量最多的元素。回答下列的问题。
(1)甲的电子式为 ,其分子为 分子(填“极性”或“非极性”)
(2)工业生产E元素的单质的化学方程式为 。
(3)A单质与C单质在一定条件下可化合为乙,工业生产乙的条件为 ,室温下,向pH=a的乙的水溶液中加入等体积pH=b的甲的水溶液,且a+b=14,充分作用后,溶液pH 7(填“>”“<”或“=”),该溶液中各种离子浓度由大到小的顺序为 。
(4)C、D两元素可形成多种化合物,其中某一化合物含C元素质量分数为46.67%,写出该化合物的化学式 ,将它转化为C的最高价含氧酸的化学方程式为 。
(5)A、B两元素也可形成多种化合物,其中分子量最小的分子为丙,则丙的空间构型为 。用D的单质和丙可以制成原电池,电池中装有浓KOH溶液,用多孔的惰性电极浸入浓KOH溶液 在X极通入化合物丙,Y极通入D的单质,则X极是该电池的 极,X极的电极反应式为 。
20.甲、乙、丙、戊都具有如图所示的结构单元,图中正四面体以外可能有部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同。已知:
 ①甲、乙是同一类晶体中各自结构单元,单质甲能与乙发生置换反应
①甲、乙是同一类晶体中各自结构单元,单质甲能与乙发生置换反应
②丙、丁、戊三种粒子含有等量的电子数,其中
丙、丁是同一类晶体中的分子或分子集团
③常温下丁呈液态,能产生两种等电子数的粒子
④戊是阳离子
(1)甲与乙发生置换反应的化学方程式是 。
(2)写出液态丁产生两种等电子粒子的电离方程式 。
(3)丙是目前重要的能源,丙和丁在催化、加热条件下得到两种可燃性的气体,其反应的化学方程式是 。
19.某化学反应的反应物和产物如下:
A1+NaNO3+H2O→A1(OH)3+N2+NaAlO2
(1)该反应的氧化剂是 。
(2)该反应的氧化产物是 。
(3)反应过程中转移5mole-,生成标况下N2的体积 L。
(4)配平该反应的化学方程式:
A1+ NaNO3+ H2O→ A1(OH)3+ N2+ NaAlO2
18.某溶液中只可能含有下列离子中的几种(不考虑溶液中含的较少的H+和OH-)Na+、NH4+、SO42-、CO32-、NO3-。取200mL该溶液,分为等体积的二份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL。实验2:第二份先加入足量的盐酸,无现象,再加足量的BaCl2溶液,得固体2.33克。下列说法正确的是
A.该溶液中可能含有Na+
B.该溶液中肯定含有NH4+、SO42-、CO32-、NO3-
C.该溶液中一定不含NO3-
D.该溶液中一定含Na+,且c(Na+)≥0.1 mol/L
|
第Ⅱ卷(非选择题,共55分)
17.0.1 mol·L-1的NH4HSO4溶液与0.1mol·L-1的NaOH溶液等体积混合,下列关于混合后溶液中离子浓度关系的表述正确的是( )
A、c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH -)
B、c(Na+)=c(SO42-)>c(NH4+)> c(OH -)> c(H+)
C、c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH -)
D、c(Na+)=c(SO42-)=c(NH4+)>c(H+)>c(OH -)
16. 已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol·L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度的下列关系中(R表示S或C),一定正确的是( )
A、c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B、c(Na+)+ c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C、c(H+)+ c(H2RO3)=c(RO32-)+c(OH-)
D、两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com