
题目列表(包括答案和解析)
1.美国哥伦比亚大学的科学家根据对沉积物质中稀土元素钕(Nd)的分析发现,北大西洋和太平洋海水中的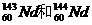 比例差异很明显,由此得出周围大陆的岩石中
比例差异很明显,由此得出周围大陆的岩石中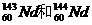 含量不同的结论。下列有关说法正确的是 ( )
含量不同的结论。下列有关说法正确的是 ( )
A.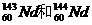 互为同素异形体
互为同素异形体
B.因各地的岩石中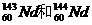 含量不同,所以Nd没有固定的相对原子质量
含量不同,所以Nd没有固定的相对原子质量
C.上述结论可以用于研究洋流从一个海盆流到另一个海盆时海水的混合状况
D.Nd是镧系元素,镧系元素都互为同位素
21.(共6分)某工厂排出的废水中含有金属Ba2+,为了测定其浓度,作如下实验:
①称取K2Cr2O7固体0.1323g溶于适量的稀硫酸中,再向其中加入过量KI,反应后用Na2S2O3 溶液与之反应,当用去27.00mL时恰好完全反应。
②另取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀,沉淀
经洗涤、过滤后,用适量的稀盐酸溶解,此时 CrO42- 转化为 Cr2O72-,再加过量KI
反应,反应液再同上述Na2S2O3 溶液反应,反应完全时,消耗Na2S2O3 溶液24.00mL,
已知有关的离子方程式为:
____Cr2O72-+____I-+_____H+=_____Cr3++____I2+____ _____I2+2S2O32-=2I-+S4O62-
(1)配平上述方程式。
(2)Na2S2O3 溶液的浓度为__________。
(3)求废水中Ba2+的物质的量浓度是多少?
贵州省兴义九中09-10学年高三上学期期中考试
20.(共8分)铅蓄电池是最常见的二次电池,它由两组栅状极板交替排列而成,极板上分别覆盖有Pb和PbO2,电解质是H2SO 4溶液。
(1)铅蓄电池放电时,其中一个电极的反应如下:
 PbO2 + 4H+ + SO42- +2e- PbSO4 + 2H2O
PbO2 + 4H+ + SO42- +2e- PbSO4 + 2H2O
该电极是 (填“正极”或“负极”)。另一个电极的反应为
。
(2)铅蓄电池充电时,总反应的化学方程式为
。
(3)若使用铅蓄电池做电源,电解CuCl2溶液。已知CuCl2溶液足量,电解使用的电极为惰性电极。若在阳极上析出气体体积为44.8 L(标准状况下),则铅蓄电池中参加反应的H2SO 4质量为 。
19.(共8分)在密闭容器中加入等浓度的CO与H2O,T ℃时发生如下反应:
CO(g) + H2O(g) 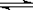 CO2 + H2(g) ΔH< 0
CO2 + H2(g) ΔH< 0
 已知CO的浓度变化如图所示。
已知CO的浓度变化如图所示。
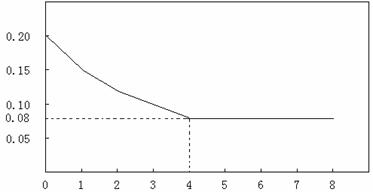
(1)从0~4 min,该反应的平均速率v(CO)= mol/(L·min)。该反应的平衡常数为 。
(2)为了增大CO的转化率,可以采取的措施有 。
|
a.增大反应物中CO的浓度 |
b.降低反应温度 |
|
c.将密闭容器体积压缩至一半 |
d.加入适宜的催化剂 |
(3)若不改变反应温度和反应物中CO的起始浓度,使CO的转化率达到90%,则水蒸气的起始浓度至少为 。
18. (共6分)在400 ℃、101 kPa时,NO2(g)+CO(g) NO(g) + CO2(g)反应过程的能量变化如下图所示。
(共6分)在400 ℃、101 kPa时,NO2(g)+CO(g) NO(g) + CO2(g)反应过程的能量变化如下图所示。
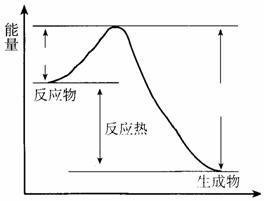
反应过程
(1)该反应是 (填“吸热”或“放热”)反应。
(2)该反应的热化学方程式为
。
(3)改变下列条件都可使该反应的反应速率改变,其中通过降低活化能加快反应速率的是 。
|
a.浓度 |
b.压强 |
|
c.温度 |
d.催化剂 |
17.(12分)下图中A、B均为固体,其中B为单质。下图可用于工业生产F。回答下列问题:
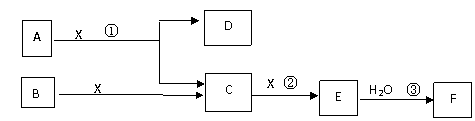
(1)A的化学式
(2)反应①是一个氧化还原反应,该反应发生时,每生成4 mol气体C,
转移电子 mol
(3)写出D与铝单质反应的化学方程式
(4)反应②是可逆反应,在2 L的密闭容器中投入4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是
A.工业制取F时,C和X生成E的反应是在吸收塔进行
B.这10分钟内,X的平均速率是0.1mol/( L·min)
C.当C和X的消耗速率比为2:1时,标志着反应达到平衡
D.平衡时C的转化率是50%
E.在工业生产中可以通过增加X的量来提高C的转化率
F.工业生产中直接用水来吸收E
(5)写出过量气体C与氢氧化钠溶液反应的化学方程式
(6)将5 mL 0.02mol/L的F溶液与5 mL 0.02 mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH是
16.(10分)某反应体系的物质有:H2SO4、KMnO4、MnSO4、CO2、K2C2O4、K2SO4、H2O。
(1)请将上述物质填入以下空格内,组成一个配平的化学反应方程式。
(2)上述反应中,被氧化的元素是_______,氧化产物是____________。
(3)当有1mol的氧化剂参加反应时,转移的电子数是_______mol。
15.(8分)尼泊金酸的结构简式为:
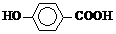
(1)尼泊金酸的分子式为____________。
(2)尼泊金酸不具有的性质是_________(选填序号)。
a. 可溶于水 b. 通常状况下呈固态 c. 发生消去反应 d. 遇FeCl3溶液显紫色
(3)1 mol尼泊金酸与下列物质反应时,最多可消耗__________(选填序号)。
a. 4 mol H2 b. 2 mol NaHCO3 c. 2 mol Br2 d. 2 mol Na2CO3
(4)将尼泊金酸与足量NaOH溶液混合后反应,生成的有机物结构简式为_________________。
(5)尼泊金酸有多种同分异构体,写出以下含有苯环的同分异构体的结构简式:
ⅰ酯类___________________________;ⅱ醛类___________________________。
14. 在容积不变的密闭容器中,在一定条件下发生反应:2A B(g) + C(g),且达到平衡。当升高温度时其内气体的密度增大,则
(
)
在容积不变的密闭容器中,在一定条件下发生反应:2A B(g) + C(g),且达到平衡。当升高温度时其内气体的密度增大,则
(
)
A.若正反应是吸热反应,则A为非气态; B.若正反应是吸热反应,则A为气态;
C.若正反应是放热反应,则A为气态; D.若正反应是放热反应,则A为非气态。
第Ⅱ卷(非选择题,共58分)
13.在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断不正确的是 ( )
A.氧化性:ClO –>I2>SO42–
B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.向氯水中加入亚硫酸钠溶液,氯水褪色
D. 次氯酸钠可以与亚硫酸钠共存
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com