
题目列表(包括答案和解析)
8.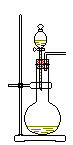 从绿色化学的理念出发,下列实验不宜用图示装置进行的是
从绿色化学的理念出发,下列实验不宜用图示装置进行的是
A.不同浓度的硝酸与铜反应
B.稀硫酸与纯碱或小苏打反应
C.铝与氢氧化钠溶液或盐酸反应
D.H2O2在不同催化剂作用下分解
7.以惰性电极电解CuCl2溶液。若阳极上产生气体的物质的量0.020 mol,则阴极上析出Cu的质量为
A.0.64 g B.1.28 g C.2.56 g D.5.12 g
6.下列指定微粒的个数比为2︰1的是
A.Be2+离子中的质子和电子 B.BaO2(过氧化钡)固体中的阴离子和阳离子
C.NaHCO3晶体中的阳离子和阴离子 D. 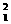 H原子中的中子和质子
H原子中的中子和质子
5.分类是学习和研究化学的一种常用的科学方法。下列分类合理的 ( )
① 根据酸电离产生H+的数目将酸分为一元酸、二元酸等
② 根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③ 根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④ 根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤ 根据反应的热效应将化学反应分为放热反应和吸热反应
A.②③ B.①②⑤ C.①②④ D.②③④⑤
4.下列关于原子结构说法正确的是
A.原子的种类是由原子核内的质子数和中子数决定的
B.核外电子排布相同的微粒,一定具有相同的化学性质
C.由符号a zX可知元素X的近似相对原子质量为a
D.次外层电子数是2或8或18的原子一定是主族元素
3.下列说法正确的是
A.原子晶体中只存在非极性共价键
B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.C4H10只能表示一种分子
2.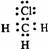
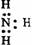
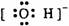 下列电子式中错误的是
下列电子式中错误的是
A.Na+ B C D.
1.下列条件下,两瓶气体所含原子数一定相等的是
A.同质量、不同密度的N2和C2H4 B.同温度、同体积的O2和N2
C.同体积、同密度的N2和N4 D.同压强、同体积的N2O和CO2
33.(13分)硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
① 将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
② 向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗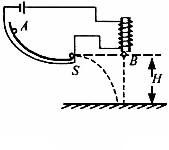 尽;
尽;
③ 趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④ 待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤ 将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
⑴ 实验步骤①的目的是____________________,加热的作用是__________________。
⑵ 实验步骤②明显不合理,理由是__________________________________________。
⑶ 实验步骤④中用少量冰水洗涤晶体,其目的是______________、______________。
⑷ 经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O、和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。
硫酸亚铁的溶解度和析出晶体的组成
|
温度/℃ |
0 |
10 |
30 |
50 |
56.7 |
60 |
64 |
70 |
80 |
90 |
||
|
溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.2 |
35.3 |
35.6 |
33.0 |
30.5 |
27 |
||
|
析出晶体 |
FeSO4·7H2O |
FeSO4·4H2O |
FeSO4·H2O |
|||||||||
若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为________。
32.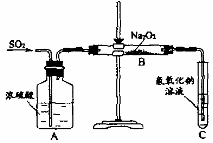 (15分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
(15分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式
是:
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
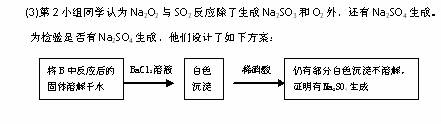
上述方案是否合理? 。请简要说明两点理由:
① ;② 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com