
题目列表(包括答案和解析)
1.氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。氢能具有的优点包括
①原料来源广 ②易燃烧、热值高 ③储存方便 ④制备工艺廉价易行
A.①② B.①③ C.③④ D.②④
14.(12分)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
取25mL甲溶液,向其中缓慢滴入乙溶液15mL,共收集到224mL(标准状况)气体。
取15mL乙溶液,向其中缓慢滴入甲溶液25mL,共收集到112mL(标准状况)气体。
(1)判断:甲是 溶液,乙是 溶液;
(2)实验中所发生反应的离子方程式为: ;
(3)甲溶液的物质的量浓度为 ,乙溶液的物质的量浓度为 ;
(4)将n mL甲溶液与等体积乙溶液按上述两种实验方式进行反应,所产生气体体积为VmL(标准状况下),则V的取值范围是 。
13.(18分)纯净的过氧化钙(CaO2)是白色的结晶粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。
已知:①在潮湿空气中CaO2能够分解:CaO2+2H2O== Ca(OH)2+H2O2,
2CaO2+2CO2==2CaCO3+ O2
②CaO2与稀酸反应生成盐和H2O2:CaO2+2H+== Ca2++ H2O2
在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。CaO2·8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2。
其制备过程如下:
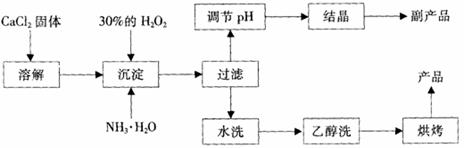
根据以上信息,回答下列问题:
(1)用上述方法制取过氧化钙的化学方程式是 ;
(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是 ;
(3)该制法的副产品为 (填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是 。
A、盐酸 B、氨水
(4)为了检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加 。
(5)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应。
第二步,向上述锥形瓶中加入几滴淀粉溶液。
第三步,逐滴加入浓度为c mol/L的Na2SO3溶液至反应完全,消耗Na2S2O3溶液VmL。(已知:I2 + 2S2O32– = 2I– + S4O62-(无色))
①第三步中说明反应恰好完全的现象是 ;
②CaO2的质量分数为 (用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“不受影响”、“偏低”或“偏高”),原因是
。
12.(12分)根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得Na2CO3固体。
四种盐在不同温度下的溶解度(g/100g水)表
 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
- |
- |
- |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
注:>35℃ ,NH4HCO3会分解
请回答:
(1)反应温度控制在30-35℃,是因为若高于35℃,则 ;若低于30℃,则 ;为控制此温度范围,采取的加热方法为 。
(2)加料完毕后,继续保温30分钟,目的是 。静置后只析出NaHCO3晶体的原因是 。用蒸馏水洗涤NaHCO3晶体的目的是除去 等杂质(用化学式表示)。
(3)过滤所得的母液中含有 等,需加入
,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1-2滴酚酞指示剂,用物质的量浓度为c(mol∙L-1 )的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL;再加1-2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)= 。
11.(18分)一般测定样品中成分含量的实验应重复二至三次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙两位同学分别设计了如下实验方案:
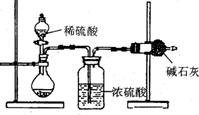 I.甲同学的方案如右图所示:
I.甲同学的方案如右图所示:
(1)根据甲同学的实验装置图分析,在每次实验过
程中所进行的称量操作至少要进行 次。
(2)甲同学重复测定了三次,得到碳酸钠的质量分
数的数据存在较大的偏差,你认为原因可能是
(填序号)。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置外空气中的水蒸气和二氧化碳被碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
D.加入稀硫酸的量不足,则可能造成误差
II.乙同学的方案是:称取样品m g,并溶解,加过量氯化钡溶液,过滤、洗涤、烘干,称量得固体n g。
(3)混合物中碳酸钠的质量分数为(用m、n表示) 。
(4)洗涤沉淀的操作要点是
。
(5) Ca2+、Ba2+都可以使CO32-沉淀完全,但乙同学使用氯化钡溶液而不用氯化钙溶液的原因是
;测定CO32-的量,若使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,原因是
。
Ⅲ (6)请你设计一个新的方案,测定纯碱样品中Na2CO3的含量:
。
10.下列画有横线的物质在反应中不能完全被消耗的是
A.将1 mol Cu置于含有2mol H2SO4的浓硫酸的容器中加热充分反应
B.将1 mol Mg置于10 L空气中(标准状况)使之在高温下反应
C.将1 mol SO2和足量的O2混合加入一个装有V2O5的容器中反应足够长的时间
D.将含少量CO2的CO气体通入盛有足量的Na2O2固体的密闭容器中,并不断用电火花引燃
9.有些反应看起来不能进行,而实际生产中恰被用来制备带下划线的物质,下列四个反应中,其反应原理与其它三个反应不同的是
A.KC1O4+H2SO4→HC1O4+KHSO4 B.KC1+NaNO3→NaC1+KNO3
C.Mg+2RbC1→MgC12+2Rb D.Na+KC1→NaC1+K
8.工业上利用下述反应在真空中炼铷:2RbCl+ Mg==MgC12+2Rb。这一反应能进行的原因是
A.在高温下镁的金属活泼性比铷强 B.铷的沸点比镁低,以气体形式被抽去
C.铷的熔点比镁低,以液体形式被抽去 D.MgC12的稳定性比RbCl的强
7.在一定温度下,向饱和烧碱溶液中放入少量过氧化钠,反应后回复到原来的温度,下列说法正确的是
A.溶液的pH增大,有O2放出 B.溶液的pH不变,有O2放出
C.溶液c(Na+)增大,有O2放出 D.溶液n(Na+)减小,有O2放出
6.取对水蒸气的相对密度为0.4的CO和H2组成的混合气体若干克,通入到盛足量的Na2O2固体粉末的容器中,并同时加入少量的O2,电火花引燃,充分反应后,称重发现固体粉末的质量增加了2.1g,则原混合气体的质量比为
A.1:4 B.2:3 C.6:5 D.7:2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com