
题目列表(包括答案和解析)
11.(6分)一些盐的结晶水合物,在温度不太高时就有熔化现象,既溶于自身的结晶水中,又同时吸收热量。它们在塑料袋中经日晒能熔化,在日落后又可缓慢凝结而释放热量,用以调节室温,称为潜热材料。现有几种盐的水合晶体有关数据如下:
|
|
Na2S2O3·5H2O |
CaCl2·6H2O |
Na2SO4·10H2O |
Na2HPO4·12H2O |
|
熔点(℃) |
40.50 |
29.92 |
32.38 |
35.1 |
|
熔化热(kJ/mol) |
49.7 |
37.3 |
77 |
100.1 |
(1)上述潜热材料中最适宜应用的两种盐是 (用化学式表示) 。
(2)实际应用时最常采用的(由来源和成本考虑)应该是 。
10.断裂一个给定的键时所消耗的能量称为离解能,提供下列烷烃的C-H键的离解能:
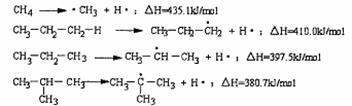
根据提供数据判断下列说法不正确的是
A.离解能愈小,C-H键易断裂,氢原子越易被取代
B.在光照条件下丙烷与氯气发生取代反应CH3CH2CH2Cl与CH3CHClCH3的物质的量之比为1:1
C.异丁烷与氯气发生取代反应,(CH3)3CCl占一氯代物的物质的量分数大于10%
D.C2H6中C-H的离解能介于410.0 kJ /mol~435.1kJ/mol
班别 座号 姓名 评分
选择题答题表
9.已知下列热化学反应方程式:
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H =-24.8kJ/mol
Fe2O3(s)+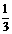 CO(g) =
CO(g) = 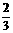 Fe3O4(s)+
Fe3O4(s)+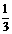 CO2(g)
△H =-15.73kJ/mol
CO2(g)
△H =-15.73kJ/mol
Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) △H =+640.4kJ/mol
则14gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H约为
A.-218kJ/mol B.-109kJ/mol C.+218kJ/mol D.+109kJ/mol
8.右图是198K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是
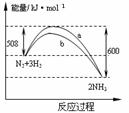 A.该反应的热化学方程式为:
A.该反应的热化学方程式为:
N2+3H2
 2NH3,△H=–92kJ·mol-1
2NH3,△H=–92kJ·mol-1
B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.加入催化剂可增大正反应速率,降低逆反应速率
7.已知乙烯和乙炔燃烧的热化学方程式分别为:
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH= -2600 kJ·mol―1
C2H4(g)+3O2(g)=2CO2(g)+2H2O(l);ΔH= -1411 kJ·mol―1
又知氧炔焰的温度比乙烯燃烧时火焰的温度高。据此,下列说法错误的是
A.物质的燃烧热越大,火焰温度越高
B.烃完全燃烧时,火焰温度的高低不仅仅取决于其燃烧热的高低
C.相同条件下等体积乙烯和乙炔完全燃烧时,乙炔放热较多
D.1mol乙烯完全燃烧生成气态产物时,放出的热量小于1411 kJ
6.将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是
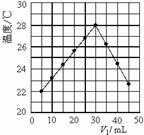 A.做该实验时环境温度为22 ℃
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.50 mol/L
D.该实验表明有水生成的反应都是放热反应
5.灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
已知:①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g);DH1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g);DH2
③Sn(s、灰)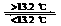 Sn(s、白);DH3=+2.1 kJ/mol
Sn(s、白);DH3=+2.1 kJ/mol
下列说法正确的是
A.DH1<DH2
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏
4.下列说法中正确的是
A.在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)= C(金刚石);△H= +119kJ·mol-1”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与1mol NaOH溶液混合,放出的热量大于57.31 kJ
D.在101Kpa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H= +285.8kJ·mol-1
3.晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)==SiO2(s)中,△H=–989.2 kJ·mol-1,有关键能数据如下表,则X的值为
|
化学键 |
Si-O |
O=O |
Si-Si |
|
键能/kJ·mol-1 |
X |
498.8 |
176 |
A.460 B.920 C.1165.2 D.423.3
2.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g) = CO2(g)+3H2(g);DH = + 49.0 kJ·mol-1
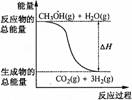 ②CH3OH(g)+1/2O2(g)
= CO2(g)+2H2(g);DH =-192.9 kJ·mol-1
②CH3OH(g)+1/2O2(g)
= CO2(g)+2H2(g);DH =-192.9 kJ·mol-1
下列说法正确的是
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+1/2O2(g) = CO2(g)+2H2(g)的DH>-192.9 kJ·mol–1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com