
题目列表(包括答案和解析)
21. (6分)向100
mL3 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴
(6分)向100
mL3 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴
加入1 mol·L-1 Ba(OH)2溶液。
(1)写出当刚好出现沉淀的总物质的量为最大值时的离子方
程式(用一个式子表示):
。
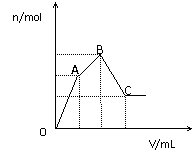
(2)随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
如图所示.写出B点和C点所对应的Ba(OH)2溶液的体积:B ,C 。
20.(5分)在Fe(OH)3胶体中,逐滴加入HI稀溶液,会出现一系列变化:
(1)先出现红褐色沉淀,原因是______________________________________________。
(2)随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式___________________。
(3)最后溶液颜色加深,原因是_____________________________________________,写出此反应的离子方程式 。
(4) 用稀盐酸代替HI的稀溶液,能出现上述哪些相同的变化现象________(写序号)。
19. (10分)聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·xH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:
(10分)聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·xH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:

(1)搅拌加热操作过程中发生反应的离子方程 ; 。
(2)生产过程中操作B和D的名称均为 (B和D为简单操作)。
(3)反应中副产品a是 (用化学式表示)。
(4)生产过程中可循环使用的物质是 (用化学式表示)。
(5) 调节pH至4.0~4.5的目的是 。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程中C物质可选用 。
A.NaOH B.Al C.氨水 D.Al2O3 E.NaAlO2
18.(6分)某澄清溶液中,可能含有NH4+、Mg2+、Na+、Fe2+、Ag+、OH–、Cl–、I–、NO3–和SO42–等离子中的几种,现进行如下实验:
(1)用pH试纸检验时,试纸呈深红色。
(2)取溶液少许,加入足量CCl4,在不断振荡的条件下加入足量氯水,静置,得上、下两层澄清溶液,其中上层呈黄色,下层呈紫色。
(3)向(2)所得溶液中加入AgNO3溶液,有白色沉淀生成。
(4)另取原溶液,调节pH使其呈中性后,加入适量的Na2S溶液,滤去产生的黑色沉淀;在滤液中继续加碱至是强碱性,得白色沉淀;过滤后给滤液加热,有刺激性气味的气体产生。
由此判断原溶液中一定有大量的 离子,一定没有 离子。不能确定有无 离子。
17.(5分)下列实验操作或设计正确的是 。
A.中和热测定实验中使用大小相同的两个烧杯和容积相等的两个量筒。
B.利用溴水或酸性高锰酸钾证明亚硫酸钠具有还原性。
C.测定熔融状态下三氯化铝的导电性,确定三氯化铝是否为电解质。
D. 为确定Na2HPO4与CaCl2溶液反应后生成的白色沉淀是难溶的Ca3(PO4)2 ,还是难溶的CaHPO4,可取反应后的上层清液,测定其pH来判断。
E.用测定熔点的方法确定某物质是纯净物还是混合物。
16.为确定某溶液的离子组成,进行实验:
①测定溶液的pH值,溶液显强碱性;
②取少量溶液加稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体;
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀;
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加Ag NO3溶液,产生白色沉淀;
根据以上实验,以下对原溶液的推测正确的是
A.一定有CO32-离子存在 B.不能确定是否存在HCO3-离子存在
C.一定有C1–离子存在 D.一定有SO32-离子存在
班别 座号 姓名 评分
选择题答题表
15.下列离子方程式中,正确的是
A.向次氯酸钙溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O==CaSO3↓+2HClO
B.足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O 2HCO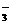
C.用碳酸钠溶液吸收少量二氧化硫: 2CO32-+SO2+H2O ==2HCO3-+SO32-
D.Ca(HCO3)2溶液与少量的NaOH溶液反应:
Ca2+ + 2HCO3- +2OH- = CaCO3↓+ CO32- + 2H2O
14.下列离子方程式中,正确的是
A.三氯化铁溶液跟过量氨水反应:Fe3 ++ 3NH3·H2O
== Fe(OH)3↓+3NH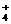
B.FeCl3溶液滴加到沸水中制备Fe(OH)3胶体: Fe3+ + 3H2O == Fe(OH)3↓+ 3H+
C.硫化亚铁溶于稀硝酸:FeS + 2H+ = Fe2+ + H2S↑
D.新制的硫酸亚铁溶液和过氧化氢溶液反应:2Fe2++2H++H2O2=2Fe3++2H2O
13.下列离子方程式中,正确的是
A.硫酸镁溶液和氢氧化钡溶液反应:SO42-+Ba2+ ==BaSO4↓
B.碳酸氢钙溶液跟稀硝酸反应:HCO3-+H+ == H2O + CO2↑
 C.偏铝酸钠的水溶液显碱性:AlO
C.偏铝酸钠的水溶液显碱性:AlO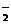 +2H2O Al(OH)3↓+OH–
+2H2O Al(OH)3↓+OH–
D.电解饱和食盐水: 2Cl-+2H+ H2↑+C12↑
H2↑+C12↑
12. 在室温下,某溶液中由H2O H++OH-这一途径产生出来的H+和OH-浓度的乘积为1×10-26,则此溶液中可能大量共存的离子组为
在室温下,某溶液中由H2O H++OH-这一途径产生出来的H+和OH-浓度的乘积为1×10-26,则此溶液中可能大量共存的离子组为
A.HCO3-、Al3+、H+、SO42- B.SiO32-、ClO-、Na+、K+
C.Cu2+、Cl-、NO3-、K+ D.I-、Fe3+、SCN-、NH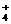
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com