
题目列表(包括答案和解析)
18. (10分)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:
(10分)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:
在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:盐基度=n(OH-)/3n(Fe)×100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe的物质的量。试回答下列问题。写出在酸性介质中用NaClO3氧化FeSO4·7H2O的离子方程式
(1)取7.51 g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.48 g , 向上述滤液中加入NH3·H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.80 g。试计算该固体聚合硫酸铁的盐基度。
(2)计算出该固体聚合硫酸铁样品的化学式。
17.(12分) 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:

( l ) A 与银氨溶液反应有银镜生成,则 A 的结构简式是
( 2 )B→C的反应类型是 。
( 3 )写出两种满足下列条件的 E 的同分异构体的结构简式
① 苯环上的一取代产物只有两种; ② 能发生银镜反应; ③ 能与 FeCl3 溶液发生显色反应。 ( 4 )写出 F 和过量 NaOH 溶液共热时反应的化学方程式:
( 5 )下列关于G 的说法正确的是
a 能与溴的四氯化碳溶液反应 b .能与金属钠反应
c .1 rnolG最多能和 3 mol 氢气反应 d . 分子式是C9H6O3
( 6 )请设计合理的方案以苯酚和乙醇为原料合成乙酸苯酯( )(用合成路线流程图表示,并注明反应条件)。提示: ① 合成过程中无机试剂任选;②合成反应流程图表示方法示例如下:
)(用合成路线流程图表示,并注明反应条件)。提示: ① 合成过程中无机试剂任选;②合成反应流程图表示方法示例如下:
16.(12分)(1)80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4  2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①计算20s-40s内用N2O4表示的平均反应速率为 mol/(L.s)
②计算在80℃时该反应的平衡常数K= ;
③反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”) ;
④要增大该反应的K值,可采取的措施有(填序号)
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(2)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e→NO+2H2O
从KMnO4、Na2CO3、Cu2O、Fe2(SO4)3这四种物质中选出一种物质(甲),甲物质能使上述还原过程发生。
①写出并配平该氧化还原反应的方程式:
②反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
③若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
(3).北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
①丙烷脱氢可得丙烯。
已知:C3H8(g) CH4(g)+HC≡CH(g)+H2(g); △H1=156.6 kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g); △H1=156.6 kJ·mol-1
CH3CH=CH2(g) CH4(g)+HC=CH(g);△H2=32.4 kJ·mol-1
CH4(g)+HC=CH(g);△H2=32.4 kJ·mol-1
则相同条件下,反应C3H8(g) CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
②以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为_________;放电时,CO32- 移向电池的_______(填“正”或“负”)极。
③常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)_____c(CO32-)
(填“>”、“=”或“<”),原因是_______________________(用文字说明)。
15. (10分)下图所示各物质是由 1 一 20 号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知 C 、 H 是无色有刺激性气味的气体, D 是一种黄绿色的气体单质,物质 J 可用于饮水消毒。反应 ② 和 ④ 是化工生产中的重要反应,反应 ⑤ 是实验室制备气体 C 的重要方法。

请回答下列问题:
( l )物质 E 的电子式是 ;物质 J 的名称为 。
( 2 )反应④的化学方程式为
反应 ⑤ 的化学方程式为
( 3)物质 A 由三种元素组成, 1 molA 与水反应可生成 1 molB 和 2 molC , A的化学式为
14. ( 12分)工业碳酸钠(纯度约为 98 % )中含有 Ca2+、 Mg2+、 Fe3+、 Cl-和 SO42-等杂质,提纯工艺线路如下:

Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:


Ⅱ.有关物质的溶度积如下
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe(OH)3 |
|
Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1) 加入NaOH溶液时,反应的离子方程式为 。
向含有Mg 2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,
c(Mg 2+)∶c(Fe3+)==
( 2 ) “母液”中除了含有 Na+、 CO32-离子外 ,还含有 等离子。
( 3 )有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析实际工业生产中是否可行 (填“可行”或“不可行”)并说明理由 。
( 4 )已知: Na2CO3 ·10H2O ( s ) ==Na2CO3 ( s ) + 10H2O ( g ) △H==+532 .36 kJ·mol-1
Na2CO3 ·10H2O ( s ) ==Na2CO3·H2O ( s ) + 9H2 O( g ) : △H =+473 . 63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式
13. ( 10 分)化合物 KxFe(C2O4)y· 3H2O ( Fe 为 +3 价)是一种光敏材料,实验室可以用如下的方法来制备这种材料并测定这种材料的组成。
Ⅰ.制备
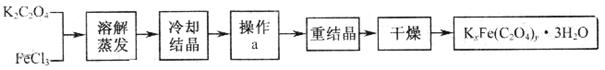
( 1 )结晶时应将溶液用冰水冷却,这样操作的原因是
( 2 )操作 a 的名称是 .
Ⅱ.组成测定
称取一定质量的晶体置于锥形瓶中,加入足量的蒸馏水和稀 HZSO 4 ,将 C2O42-转化为 H2C2O4后用 0 .1000 mol/LKMnO4溶液滴定,当消耗 KMnO4溶液 24.00mL 时恰好完全反应;再向溶液中加入适量的还原剂,恰好将 Fe3+完全转化为 Fe2+,用相同浓度的 KMnO4溶液继续滴定,当 Fe2+完全氧化时,用去 KMnO4溶液 4.00mL 。第二次滴定的离子方程式为
(3)配制 100mL0.1000 mol/LKMnO4溶液及滴定实验中所需的玻璃仪器除烧杯,玻璃棒、胶头滴管、量筒、锥形瓶外还有 (填仪器名称)。
( 4)该化合物 KxFe(C2O4)y· 3H2O中x=
12.某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a ,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
第Ⅱ卷 (非选择题,共78分)
11. 普通水泥在固化过程中自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:
普通水泥在固化过程中自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:
2Cu+ Ag2O= Cu2O 十2Ag下列有关说法正确的是
A. 工业上以黏土、石灰石和石英为主要原料来制造普通水泥
B. 负极的电极反应式为 Cu十 2OH- -2e-==Cu2O + H2O
C. 测量原理示意图中,电流方向从 Cu 经过导线流向 Ag2O
D. 电池工作时,溶液中 OH-向正极移动
10.一定温度下可逆反应:A(s)+2B(g) C(g)+D(g) △H<0。现将1mol A和2molB加入甲容器中,将2 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是
C(g)+D(g) △H<0。现将1mol A和2molB加入甲容器中,将2 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是
A.保持温度和活塞位置不变,甲中再加入1 mol A和2molB,达到新的平衡后,c(B)甲=c(B)乙
B.保持温度和乙中压强不变 ,向乙中加入2 mol D,达到新平衡 后,c(B) 乙≤2c(B) 甲
C.若该温度下反应的K=1,则甲中B和乙中C的转化率均为66.7%
D.保持活塞位置不变,升高温度,达到新的平衡后甲、乙中B的体积分数均增大


|
|

 P
P

9. “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素( EGC )的结构如图所示。关于 EGC 的下列叙述中不正确的是
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素( EGC )的结构如图所示。关于 EGC 的下列叙述中不正确的是
A.能发生加成反应、氧化反应和取代反应
B . 遇 FeC13 溶液能发生显色反应
C. 分子中所有的原子可能共平面
D. l mol EGC 与 4 mo1NaOH 恰好完全反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com