
题目列表(包括答案和解析)
18.常温下Ca(OH)2溶于水达到饱和时存在如下关系:Ca(OH)2(s) Ca(OH)2(aq),Ca(OH)2(aq)=Ca2+(aq)+2OH-(aq),若饱和石灰水的密度为dg/cm3,溶液的pH=12,则该温度下Ca(OH)2的溶解度为(单位:g)
Ca(OH)2(aq),Ca(OH)2(aq)=Ca2+(aq)+2OH-(aq),若饱和石灰水的密度为dg/cm3,溶液的pH=12,则该温度下Ca(OH)2的溶解度为(单位:g)
A.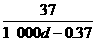 B.
B.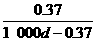 C.
C.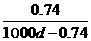 D.
D.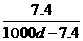
17.某铁的“氧化物”用50 mL 1.4 mol·L-1的盐酸恰好溶解,所得溶液还能吸收标准状况下56 mL的Cl2,则该“氧化物”的化学式为
A.Fe2O3 B.Fe5O7 C.Fe4O5 D.Fe2O4
16.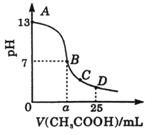 25℃时,在25
mL 0.1mol/L的NaOH溶液中,逐滴加入0.2mol/L的CH3COOH溶液,溶液pH的变化曲线如图所示。下列分析的结论正确的是
25℃时,在25
mL 0.1mol/L的NaOH溶液中,逐滴加入0.2mol/L的CH3COOH溶液,溶液pH的变化曲线如图所示。下列分析的结论正确的是
A.B点的横坐标a=12.5,且有c(Na+)=C(CH3COO-)
B.C点时C(Na+)>C(CH3COO-)>c(H+)>c(OH-)
C.D点时C(CH3COO-)+C(CH3COOH)=2C(Na+)
D.对曲线上A、B间任一点,溶液中都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
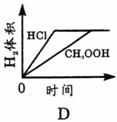
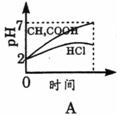
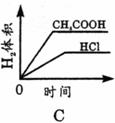
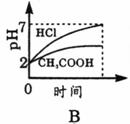
15.常温下,在体积均为1L pH同为2的盐酸和酸酸溶液中,分别投入0.23g金属钠,图中符合实验事实的是
14.常温下,将pH为8的NaOH溶液与pH为10的NaOH溶液等体积混合后,溶液中的氢离子浓度约为
A. (10-8+10-10)mol/L
B.(10-8+10-10)mol/L
(10-8+10-10)mol/L
B.(10-8+10-10)mol/L
C.(1×10-14+5×10-5)mol/L D.2×10-10mol/L
13.某溶液中大量存在五种离子:NO3-、SO42-、Fe3+、H+、X,其物质的量之比为:
n(NO3-):n(SO42-):n(Fe3+):n(H+):n(X)=2:3:1:3:1,则X可能为
A.Fe2+ B.Mg2+ C.Cl- D.Ba2+
12.已知在0.1mol·L-1的NaHSO3溶液中:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),下列分析不合理的是
A.溶液呈酸性 B.c(SO32-)+c(HSO3-)=0.1mol·L-1-c(OH-)
C.2c(SO32-)+c(HSO3-)+c(OH-)=c(Na+)+c(H+) D.c(SO32-)+c(OH-)=c(H2SO3)+c(H+)
11.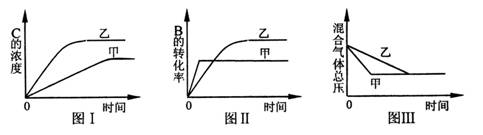 在容积固定的密闭容器中存在如下反应:A(g)+3B(g)
在容积固定的密闭容器中存在如下反应:A(g)+3B(g) 2C(g);△H<0。某同学研究了在其它条件不变时,改变某一条件对上述反应化学平衡的影响,并根据实验数据作出下列关系图。下列判断一定错误的是
2C(g);△H<0。某同学研究了在其它条件不变时,改变某一条件对上述反应化学平衡的影响,并根据实验数据作出下列关系图。下列判断一定错误的是
A.图Ⅰ研究的是不同反应物浓度对反应的影响,且乙使用的反应物浓度较大
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
10.密闭容器中,反应xA(g)+yB(g) zC(g),达到平衡时,A的浓度为0.5mol·L-1,若保持温度不变,将容器的容积扩大到原来的2倍,达到平衡时A的浓度降为0.3 mol·L-1。下列判断正确的是
zC(g),达到平衡时,A的浓度为0.5mol·L-1,若保持温度不变,将容器的容积扩大到原来的2倍,达到平衡时A的浓度降为0.3 mol·L-1。下列判断正确的是
A.C的体积分数下降 B.平衡向正反应方向移动
C.B的转化率增加 D.x+y<z
9.若阿伏加德罗常数为6.02×1023mol-1,下列叙述正确的是
A.1 L 1 mol·L-1 醋酸溶液中含离子总数为2×6.02×1023
B.0.1 L 2mol·L-1Na2CO3溶液中所含CO32-的数目为0.2×6.02×1023
C.将1mol FeCl3与沸水反应制成氢氧化铁胶体,所得胶体粒子的数目为6.02×1023
D.一定温度下,1 L 0.5mol·L-1 NH4Cl溶液与2 L 0.25 mol·L-1 NH4Cl溶液所含NH4+的物质的量不同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com