
题目列表(包括答案和解析)
26.下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及 夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
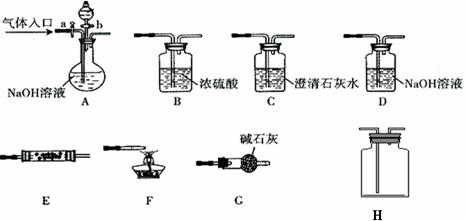
(1)实验前,如何检查A装置的气密: 。
(2)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为 (填代号)。能验证CO氧化产物的现象是 。
(3)若A中气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,H为空瓶,D中改为石蕊试液,按A→G→E→H→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有 。
②实验中先用酒精灯加热催化管,再通入混合气体,可观察到H内有红棕色气体出现,D中石蕊试液变红,则E中发生反应的方程式为 。
③若把酒精灯撤去,继续通入气体,催化剂可继续保持红热状态,反应继续进行。能使催化剂继续保持红热的原因是: 。
④某同学在做上述实验时出现了与其他同学不同的现象,他发现催化剂红热现象明显而正常,但石蕊试液不变红。请分析可能的原因:(答两点即可)
。
25.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
 请回答下列问题:
请回答下列问题:
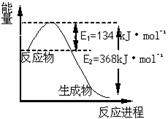
(1)右图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式 :
。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行
|
t/℃ |
200 |
300 |
400 |
|
K |
K1 |
K2 |
0.5 |
如下化学反应:N2(g)+3H2(g) 2NH3(g)
⊿Q>0,
2NH3(g)
⊿Q>0,
其化学平衡常数K与温度t的关系如右表:
请完成下列问题;
①写出以上反应的化学平衡常数的表达式: 。
②试比较K1、K2的大小,K1 K2(填写“>”、“=”或“<”)
③下列各项能作为判断该反应达到化学平衡状态的依据是 (填序号字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.υ(N2)(正)=3υ(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
④400℃时,反应2NH3(g)  N2(g)+3H2(g)的化学平衡常数的值为
。
N2(g)+3H2(g)的化学平衡常数的值为
。
当测得NH3和N2、H2的物质的量分别为3 mol和2 mol、1 mol时,则该反应的
υ(N2)(正) υ(N2)(逆)(填写“>”、“=”或“<”=)
24.2007年2月27日某市工商局查获400克袋装中老年补钙营养奶粉1401包。这种奶粉被鉴定为所含亚硝酸盐残留量高出正常值7.8倍,长期食用可能致癌。NaNO2有像食盐一样的咸味。已知NaNO2能发生如下反应:2NaNO2 + 4HI→2NO↑ + I2 + 2NaI+ 2H2O
(1)上述反应中氧化剂是 ,若有0.75mol的还原剂被氧化,则被还原的氧化剂是 mol。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①自来水 ②碘化钾淀粉试纸 ③淀粉 ④白糖 ⑤食醋 ⑥白酒。
进行实验时,必须选用的物质有 。(填序号)
(3)某厂废切削液中,含2%-5%的NaNO2,直接排放会造成污染,下列试剂 (填序号)能使NaNO2转化为不引起二次污染的N2 。
① NaCl ② NH4Cl ③ H2O2 ④ 浓H2SO4。
反应的化学方程式为:(并标出电子转移的数目和方向)。
23. 四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
|
元素 |
T |
X |
Y |
Z |
|
性质 结构 信息 |
原子核外s电子总数等于p电子总数;人体内含量最多的元素,且其单质是常见的助燃剂。 |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼 |
单质质软、银白色固体、导电性强。单质在空气中燃烧发出黄色的火焰。 |
第三周期元素的简单离子中半径最小 |
(1)写出元素T在周期表中的位置: 。元素Y的原子核外共有______种形状不同的电子云。
(2)写出元素X的气态氢化物的结构式: ;写出Z元素原子的核外电子排布式: ;
(3)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式:
(4) 元素T与氟元素相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目
22.向某NaOH溶液中通人CO2气体后得溶液M,因CO2通人量的不同,溶液M的组成也不同。若向M中逐滴加人盐酸,产生的气体体积V(CO2)与加人盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别有OA<AB,OA=AB,OA>AB,则下列分析与判断不正确的是(不计CO2的溶解)
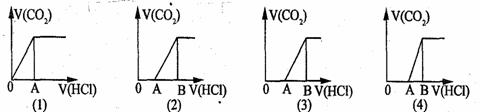
A.⑴图显示M中只有一种溶质 B.⑵图显示M中c(NaHCO3)>c(Na2CO3)
C.⑶图显示M中只有一种溶质 D.⑷图显示M中c(NaHCO3)>c(Na2CO3)
第Ⅱ卷 非选择题部分(共84分)
21.今有室温下四种溶液,有关叙述正确的是
|
|
① |
② |
③ |
④ |
|
pH |
11 |
11 |
3 |
3 |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH ①=②>③=④
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.VaL④与VbL②溶液混合后,若混合后溶液pH=4, 则Va ∶Vb= 11∶9
20.如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下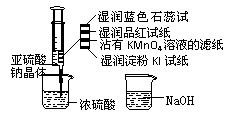 列有关说法正确的是
列有关说法正确的是
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、沾有KMnO4溶液滤纸均褪色都能
证明SO2的漂白性
C.湿润淀粉KI试纸未变蓝说明SO2的氧化性弱于I2
D.NaOH溶液可用于除去实验中多余的SO2
19.荧光素是发光物质的基质, 5-羧基荧光素与5-羧基二乙酸荧光素在碱性条件下有强烈的绿色荧光,它们广泛应用于荧光分析等。下列说法不正确的是

A.5-FAM转变为5-CFDA属于取代反应
B.5-FAM的分子式为:C21H12O7
C.5-FAM和5-CFDA 各1mol分别与足量NaOH溶液反应,消耗氢氧化钠物质的量相同
D.实验室鉴别5-FAM与5-CFDA可用碳酸氢钠溶液
18.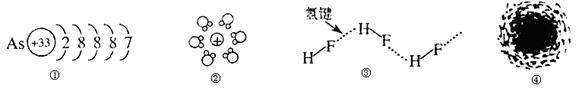 用示意图或图示的方法能够直观形象地将化学知识传授给学生,下列示意图或图示正确的是
用示意图或图示的方法能够直观形象地将化学知识传授给学生,下列示意图或图示正确的是
A.①表示砷原子结构示意图 B.②表示水合钠离子示意图
C.③表示HF分子间的氢键 D.④表示在通常状况下氢原子电子云示意图
17.已知某溶液中只存在OH-、H+、Cl-、NH4+四种离子,其离子浓度可能有如下关系:
① c(Cl-)>c(NH4+)>c(H+)>c(OH-) ② c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③ c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④ c(NH4+) =c(Cl-)>c(OH-)=c(H+)
下列说法正确的是
A.若①正确,则溶液中溶质一定为NH4Cl
B.若③正确,则溶液中c(NH3·H2O) + c(NH4+)>c(Cl-)
C.若④正确,且盐酸和氨水体积相等,则盐酸中c(H+)等于氨水中c(OH-)
D.溶质不同时,上述四种关系式均可能成立
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com