
题目列表(包括答案和解析)
3.下列电子式中错误的是
A. Na+ B. 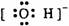 C.
C. 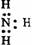 D.
D. 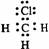
2.化学与人类生活密切相关。下列说法不正确的是
A.维生素C具有还原性,可用作食品抗氧化剂
B.为防止铁制品生锈,可在铁制品的外层涂油漆或局部镀铜
C.推广燃煤脱硫技术,可减少SO2气体对大气的污染
D.不可用铝制餐具长时间存放酸性、碱性食物
1.下列措施不能达到节能减排目的是
A.利用太阳能制氢燃料 B.用家用汽车代替公交车
C.利用潮汐能发电 D.用节能灯代替白炽灯
27.(13分)芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素。相同状况下A、B蒸汽对氢气的相对密度都是97,分子中C、H原子个数相同,且C、H原子总数是氧原子数的5倍。
已知:各有机物之间存在如下转化关系

其中C能发生银镜反应,F经连续氧化可生成C;C与D是相对分子质量相同的不同类有机物。
(1)A的分子式是 。
(2)E中所含官能团的名称是 。完全燃烧时,1mol D 与1 mol 下列
的耗氧量相同(填字母代号)。
a. C3H6O3 b. C3H8O c. C2H4 d. C2H6O2
(3)B的结构简式是 。
水杨酸与小苏打反应的化学方程式是 。
C与F反应的化学方程式是 ,反应类型是 。
(4)同时符合下列要求的同分异构体有 种。
①与A互为同分异构体 ②可以水解 ③苯环上有两个取代基,且苯环上的一氯
代物只有1种。
(5)1 mol 上述(4)中的一种有机物X,能与4 mol NaOH发生反应,写出此反应的化学方程式 。
福建省永春一中、培元中学、季延中学、石光华侨联中2010届高三上学期期末联考
26.(13分)下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
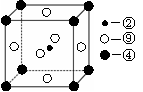 (2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的
体心、顶点、面心),则该化合物的化学式为
(用对应的元素符号表示)。
(3)元素②的一种氢化物是重要的化工原料,
常把该氢化物的产量作为衡量石油化工发展水
平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。

请回答:表中的金属元素是 (填字母),其中化合价为+3价的是 (填字母);若A、B、C依次为同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是
。
[有机化学基础]
25.(16分)某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此兴趣小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。已知:常温下,CO能使一些化合物中的金属离子还原
 例如:PdCl2 + CO + H2O=Pd↓+ CO2 +2HCl 。反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
例如:PdCl2 + CO + H2O=Pd↓+ CO2 +2HCl 。反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。

请回答下列问题:
(1)通常实验室制取CO2气体的离子方程式是 ,为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是___ (填写 “Ⅰ”、“Ⅱ”或“Ⅲ”)。若要制取干燥、纯净的CO2气体,装置B中应盛放的试剂是 溶液,装置C中应盛放的试剂是________ 。
(2)观察实验装置图可知Na与CO2反应的条件是_____________。检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是____________________。待装置______(填写字母)中出现 现象时,再点燃酒精喷灯,这步操作的目的是 。
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
(4)请用文字简要说明你判断②中D装置生成固体的成分是钠的正盐或酸式盐的理由。 。
选考部分
第II卷选考部分共2题,共13分。请从第26、27两道题中任选一题作答,若第26、27两道题都作答,则按第26题计分。请将答案填写在答题卷选答区域的指定位置上
[物质结构与性质]
24.(11分)工业合成氨与制备硝酸一般可连续生产,流程如下:
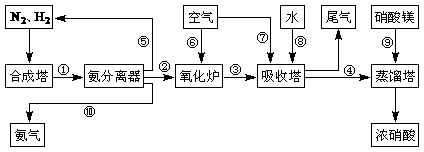
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2
CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的转化率α(H2O)=________。
 (2)合成塔中发生反应N2(g)+3H2(g)
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中
T1____573K(填“>”、“<”或“=”)。
 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1
不同温度下NO产率如图所示。温度高于900℃时,
NO产率下降的原因 。
(4)吸收塔中发生反应的化学方程式为:
。
(5)上述工业流程中,采用了循环操作工艺的是 (填序号)
(6)硝酸厂的尾气含有氮氧化物,如果不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:_____________________________。
23.(9分)某课外活动小组同学用下图装置进行实验,试回答下列问题:
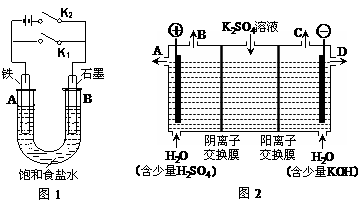
Ⅰ.以图1的实验装置进行实验。
(1)若开始时打开开关K2,闭合开关K1,则该装置为 (填装置名称)。
(2)若开始时打开开关K1,闭合开关K2,则:
四校2010届高三毕业班期末联考化学试卷 第7页 (共12页)
①U型管里总反应的离子方程式为 
②对于上述实验,下列说法正确的是 (填序号)。
A. 溶液中Na+向B极移动
B. 从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C. 反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D. 若标准状况下从A极逸出2.24L气体,则外电路上通过的电子数目略大于0.2NA
Ⅱ.以图2的实验装置进行实验。
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口 (填“A”、“B”、“C”、“D”)导出。
③通电开始后,阴极附近溶液的pH会增大,请简述原因 。
22.(9分)A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1:4。请回答:
(1)若Y是黄绿色气体,则Y的电子式是 ,该反应的化学方程式是:
。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是 。
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中
①A元素在周期表中的位置是 (填所在周期和族);Y的化学式是 。
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是 mol。
(4)若A、B、X、Y均为化合物。A溶于水电离出的阳离子和水作用的生成物可净化水,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是 。
21. 25℃时,某硫酸铜溶液的溶质质量分数为w,物质的量浓度为cmol/L,密度为ρg/mL,将此溶液蒸去a g水或再向原溶液中加入b g无水硫酸铜粉末,充分静置并恢复至25℃时,均恰好全部转化为CuSO4·5H2O晶体。则下列关系式正确的是 ( )
A.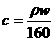 B.
B.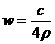 C.
C.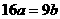 D.
D.
第Ⅱ卷(非选择题 共58分)
必考部分
第Ⅱ卷必考部分共4题,共45分。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com