
题目列表(包括答案和解析)
7、下列有关铜电极的叙述正确的是( )
A、铜、锌原电池中铜作负极
B、在铁制品上电镀铜时,用铜作阴极
C、电解饱和食盐水制烧碱时用铜作阳极
D、电解法精炼铜时,粗铜连接电源的正极
6、已知在酸性条件下有如下反应:2Cu+=Cu2++Cu由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体,一同学对某次用氢气还原氧化铜的实验所得的红色产物作了验证,实验操作和实验现象记录如下:
|
加入试剂 |
稀硫酸 |
浓硫酸、加热 |
稀硝酸 |
浓硝酸 |
|
实验现象 |
红色固体 和蓝色溶液 |
无色气体 |
无色气体 和蓝色溶液 |
红棕色气体 和绿色溶液 |
由此推出本次氢气还原氧化铜实验产物是( )
A、Cu B、Cu2O
C、一定有Cu可能有Cu2O D、一定有Cu2O可能有Cu
5、几种短周期元素的主要化合价及其原子的原子半径数据见下表:
|
元素代号 |
L |
M |
Q |
R |
T |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+7、-1 |
-2 |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.099 |
0.074 |
根据表中信息,判断下列有关叙述正确的是( )
A、L、M的单质分别与同浓度的稀盐酸反应时,L的单质反应更剧烈
B、M与T形成的化合物不能与碱反应
C、Q、T两元素的氢化物的热稳定性比较:Q氢化物的大于T的氢化物的
D、L和T两元素形成的化合物中有共价键
4、对比联想是学习化学的重要方法,下列对比正确的是( )
A、Fe3O4与HCl的反应为:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,故Pb3O4与HCl的反应为:Pb3O4+8HCl=PbCl2+2PbCl3+4H2O
B、NH4Cl受热易分解,方程式为:NH4Cl NH3+HCl,在同样条件下NH4I分解的方程式为:NH4I
NH3+HCl,在同样条件下NH4I分解的方程式为:NH4I NH3+HI
NH3+HI
C、 Na2O2与CO2的反应为:2Na2O2+2CO2=2Na2CO3+O2↑,故Na2O2与SO2反应的方程式为:2Na2O2+2SO2=2Na2SO3+O2↑
D、CaC2的水解反应为:CaC2+2H2O=Ca(OH)2+C2H2↑,故Mg3N2水解反应为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
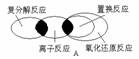
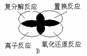
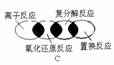
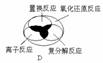
3、离子反应、复分解反应、置换反应和氧化还原反应之间可用下列集合关系表示,其中正确的是()
2、氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
A、氢元素只能与非金属元素化合生成氢化物
B、因非金属元素只有一种最低负价,故氢元素与非金属元素只能生成一种氢化物
C、同主族非金属元素对应的氢化物随相对分子质量的增加,熔、沸点逐渐升高
D、第ⅫA族元素氢化物的还原性、水溶液的酸性逐渐增强,但是它们的稳定性逐渐减弱
1、当前由美国的金融危机正变成世界经济危机,中国政府为防止经济加速下滑,加大了救市力度,计划投入了四万亿的拉动内需资金,这也必将刺激国内钢材、水泥、玻璃等建材消费,下列有关说法不正确的是( )
A、钢化玻璃与普通玻璃的主要成分不同
B、硅是人类将太阳能转化成电能的常用材料,高纯度单质硅可以制成光电池
C、不同的建筑对水泥的要求不一样,同时水泥的吸水能力很强,短期保存也要注意防潮
D、普通水泥的主要成分是:3CaO·SiO2、2CaO·SiO2、3CaO·Al2O3
18.(21分)现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。(由实验装置引起的实验误差忽略不计)。
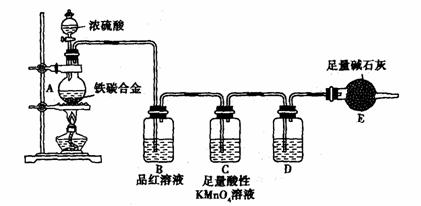
Ⅰ.探究浓硫酸的某些性质
(1) 称量E的质量;按照图示连接装置,检查装置的气密性。
(2) 将m g铁碳合金样品放入A中,再加入适量的浓硫酸。未点燃酒精灯前,A、B均无明显现象,其原因是:________________________。C中足量的酸性KMnO4溶液所起的作用是 。D中盛放的试剂是 。
(1) 反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是___________________________________________________。
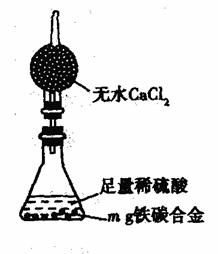 Ⅱ.测定铁的质量分数
Ⅱ.测定铁的质量分数
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g,则铁碳合金中铁的质量分数为__________________________(写表达式)。某同学认为:依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,你认为可能的原因是____________________________。
(5) 经过大家的讨论,决定采用下列装置和其他常用实验仪器测定某些数据即可,为了快速和准确地计算出铁的质量分数,最简便的实验操作是______________________(填写代号)。
①用排水法测定H2的体积
②反应结束后,过滤、洗涤、干燥、称量残渣的质量
16.(18分)已知A、B、C、D四种短周期元素的原子序数依次增大,B的核电荷数是A、D核电荷数之和的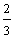 倍;A能分别与B、C、D形成电子总数相等的分子X、Y、Z。请回答下列问题:
倍;A能分别与B、C、D形成电子总数相等的分子X、Y、Z。请回答下列问题:
(1)B、D两元素的名称分别是 、 。
(2)化合物B2A2的电子式为 。
(3)Y与C的最高正价氧化物的水化物刚好完全反应时,其生成物的水溶液呈 性(填“酸”“碱”或“中”),其原因是(用离子方程式表示) 。
(4)在(3)所得生成物的水溶液中,存在着如下关系,用粒子浓度符号填写:
① c(H+)+ =c(OH-)+ ;
② c(H+)= c(OH-)+ 。
(5)若0.2 mol液态化合物B2A8C2与液态C2D4完全反应,生成气态的C2、Z和BD2,同时放出510 kJ热量,试写出该反应的热化学方程式:
__________________________________________________________________
(6)化合物C2A4是可燃性液体,也可用作火箭燃料。C2A4-空气燃料电池是一种碱性燃料电池,电解质溶液是20 %-30 % 的KOH溶液,放电时生成C2、Z, 则C2A4-空气燃料电池放电时,负极的电极反应式是____________ ______。
17(15分).据报道:美国海军科学家拟提取海水中溶解的二氧化碳,利用类似FT合成的方法生产短链不饱和烃,以作为汽油的替代品。研究发现,如果使用铁作催化剂,二氧化碳与氢气反应产生30%的甲烷,其余的短链烃可以被用来提炼燃料。
(1)为延缓全球温室效应,二氧化碳捕获和封存技术(CCS)是当今化学的前沿技术,下列通过化学反应捕获二氧化碳的反应,其原子利用率达100%的是 ▲ 。
(a)CO2 +CaO  CaCO3
CaCO3
(b)K2CO3+CO2+H2O=2KHCO3
(c)2Mg+CO2 2MgO+C
2MgO+C
(d)
(2)用二氧化碳合成烃,需要提供辅助原料氢气,下列制取氢气的方法可行且二氧化碳零排放的是 ▲ 。
(a)用太阳能光解海水制氢 (b)利用天然气与水高温催化制氢
(c)利用活泼金属与海水反应制氢 (d)利用核反应堆多余的电能电解海水制氢
(3)所谓FT合成,就是CO在金属催化剂上催化氢化反应,生成以直链烷烃和烯烃为主的混合物的过程。CO2与H2合成汽油(平均组成设为C8H18)反应的化学方程式为: ▲ 。
(4)某文献报道:在300℃、30MPa,以Fe、CoCl2作催化剂条件下,CO2和H2反应生成丁烷和戊烷。
①假定在一实验容器中充入一定量的CO2和H2,加入催化剂,若CO2和H2转化率均为100%,产物只有丁烷和戊烷, n(H2)/n(CO2)=a,a取值范围为: ▲ 。
②据问题①,今有标准状况下的CO2448L, n(丁烷)/n(戊烷) =x,消耗H2的物质的量为y,则y= ▲ (用x表示)。
15. (10分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。请就“三大酸”与金属铜的反应情况,回答下列问题:
(1)在100mL 18mol/L的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是
A.40.32L B.30.24L 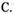 20.16L D.6.72L
20.16L D.6.72L
有同学提出,若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,请判断该方案是否可行?若不可行,请说明原因。若可行,请写出反应的离子方程式 。
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是 。则反应中所消耗的硝酸的物质的量可能为
A.0.1mol B.0.15mol C.0.2mol D.0.25mol
(3)①甲同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为 .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com