
题目列表(包括答案和解析)
17、(10分)向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应:2X(g) Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5分钟后反应达到平衡,此时测得容器内的压强为反应前的1.2倍,则用Y表示的反应速率为_________mol/(L·min)。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲:v(X)=3.5mol/(L·min);乙:v(Y)=2mol/(L·min);丙:v(Z)=4.5mol/(L·min);丁:v(X)=0.075mol/(L·s)。若其他条件相同,温度不同,则温度由高到低的顺序是(填序号)__________________。
(3)若向达到(1)的平衡体系中充入氮气,则平衡向______(填“左”“右”“不”)移动;若向达到(1)的平衡体系中移走部分混合气体,则平衡向______(填“左”“右”“不”)移动。
(4)若在相同条件下向达到(1)的平衡体系中再充入0.5mol的X气体,则平衡后X的转化率与(1)的平衡中X的转化率相比较( )
A、无法确定 B、前者一定大于后者 C、前者一定等于后者 D、前者一定小于后者
(5)若保持温度与压强不变,起始时加入X、Y、Z和物质的量分别为amol 、bmol、 cmol,达到平衡时仍与(1)是等效平衡,则a、 b、 c应满足的关系是____________。
(6)若保持温度与体积不变,起始时加入X、Y、Z和物质的量分别为amol 、bmol、 cmol,达到平衡时仍与(1)是等效平衡,且起始时维持化学反应向逆方向进行,则c的取值范围是________________。
16、(8分)X、Y、Z为常见的三种单质,Z是绿色植物光合作用后的产物之一,A、B为常见化合物。它们在一定条件下可以发生如图反应(均不是在溶液中进行的反应)(以下每个空中填入一种即可)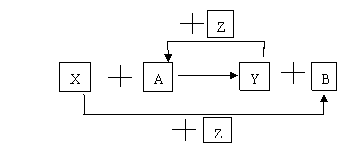

(1)当X、Y均为金属时,Y的化学式为_______,B的化学式为________。
(2)当X为非金属,Y为金属时,X的化学式为_______,A的化学式为_____。
(3)当X为金属,Y为非金属时,写出X和A反应的化学方程式___________。
(4)当X、Y均为非金属时,写出X和A反应的化学方程式________________。
15、(12分)Ⅰ.化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。
(1)下列关于实验的叙述正确的是 。
A、燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
B、在两支试管里分别加热NH4Cl和NH4HCO3,现象完全相同
C、在铝热反应的实验中,用滤纸做的漏斗必须干燥
D、用滴有酚酞的水做氨的喷泉实验,只验证了氨的溶解性
E、验证CO2中混有SO2时,可将混合气体通过品红溶液
(2)下列实验装置没有错误的一项是
。
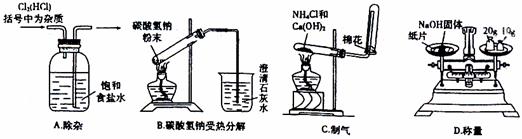
Ⅱ.实验室可以通过三条途径按不同要求来制取氮:
①加热条件下用NH3还原CuO制得纯净的N2和活性铜粉;
②将空气通过灼热的活性铜粉制得较纯净的N2;
③加热NaNO2(一种致癌物质,有剧毒)与NH4Cl的混合浓溶液制取N2。
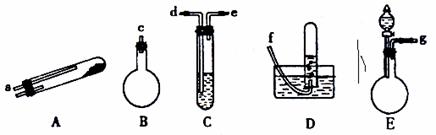 如图所示,给出了按上述途径制N2的可供选择的几种实验仪器,其他必要的仪器如铁架铁夹、铁圈、石棉网、酒精灯等未列出。
如图所示,给出了按上述途径制N2的可供选择的几种实验仪器,其他必要的仪器如铁架铁夹、铁圈、石棉网、酒精灯等未列出。
(1)按途径①制取N2时所需的氨气要用浓氨水与生石灰作原料制取,最好要用上述仪器中的 (填仪器代码,下同)作为氨气发生装置,该反应的化学方程式为 。要制取并收集纯净的N2(允许含少量的水蒸气),还应使用到上述仪器中的 (按气流从左到右的顺序列出)。
(2)按途径②制取N2,原料气空气是通过向 (填上述仪器代码)中加入 而送入反应器的,反应器内发生的现象是 。
(3)上述三种制取N2的途径,①和②两条途径常常被协同使用而越来越受到人们的关注,这种方法与途径③相比其优越性在于 。
14、(8分)以下是25℃几种物质的溶解度:
|
难溶电解质 |
Mg(OH) 2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中常利用难溶盐的溶解平衡原理除去某些杂质离子。例如:
①为了除去氯化氨中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂充分反应后,过滤结晶即可。
②为了除去氯化镁中的杂质Fe3+,先将混合物溶于水,再加入足量的氢氧化镁充分反应,过滤结晶即可。
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,再加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三个方案都能达到很好的效果,Fe2+、Fe3+都被转化成______(填化学式)而除去。
(2)①中加入的试剂应该选择______为宜,其原因是_______________________。
(3)②中除去Fe3+所发生的总反应的离子方程式为____________________________。
(4)下列与方案③相关的叙述中正确的是( )
A、H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B、将Fe2+氧化成Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C、调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D、Cu2+可以大量存在于pH=4的溶液中
E、在pH>4的溶液中,Fe3+一定不能大量存在
13、现有一混合物的水溶液,含有以下离子中的若干种:Na+、NH4+、Cl-、Ba2+、HCO3-、SO42-、现取三份各100mL该溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加入足量NaOH溶液加热,收集到标准状况下的气体448mL
(3)第三份加入足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,下列推测正确的是( )
A、Na+一定存在
B、100mL该溶液中含有0.01molHCO3-
C、Ba2+一定存在
D、Cl-一定不存在
第Ⅱ卷(非选择题 共56分)
12、物质的提纯是化学实验中的一项重要操作,也是化工生产及物质制备中的主要的环节,下列有关叙述中不正确的是( )
A、乙酸乙酯是混有乙酸,可选用饱和Na2CO3溶液洗涤,然后将两层液体分开
B、在提纯鸡蛋中的蛋白质时,可向鸡蛋清溶液中加入浓(NH4)2SO4溶液,然后得到沉淀滤出,即得较纯的蛋白质
C、油脂的提纯中,可将油脂加入NaOH浓溶液中加热,然后过滤,滤出的溶液即为较纯的油脂
D、甘蔗是制备蔗糖的主要原料,榨出的甘蔗汁因含有色素而呈黄色,在制取蔗糖前应先加入适量的活性炭,经搅拌、过滤、蒸发结晶,即得较纯的蔗糖
11、将等物质的量F2和ClF混合,在密闭容器中发生反应:F2(g)+ClF(g) ClF3(g);△H﹤0。下列叙述中正确的是()
ClF3(g);△H﹤0。下列叙述中正确的是()
A、恒温恒容时,当ClF转化40%时,容器内的压强为初始时的0.8倍
B、当c(F2)︰c(ClF)︰c(ClF3)=1︰1︰1时,反应一定达到平衡状态
C、达到平衡时若增大容器体积,正反应速率减小,逆反应速率增大,平衡左移
D、达到平衡后再降低温度,保持恒容,达到新的平衡时混合气体的平均摩尔质量增大
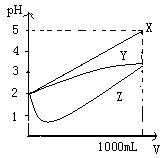
10、pH=2的X、Y、Z三种溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积关系如图所示,下列说法错误的是( )
A、X是强酸,Y和Z是弱酸
B、稀释前的浓度大小为c(Z)>c(Y)>c(X)
C、稀释前的电离程度大小为X>Y>Z
D、pH=2时,X、Y、Z都是稀溶液
9、常温下将一元酸HA溶液与一元碱BOH溶液等体积混合,所得溶液显酸性,下列有关判断正确的是()
A、若混合前酸、碱pH之和等于14,则HA酸一定是弱酸
B、若混合前酸、碱物质的量浓度相同,则BOH一定是弱碱
C、溶液中水的电离程度:混合溶液>水>BOH
D、混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-)
8、下列对离子方程式的有关叙述正确的是( )
A、稀硝酸中加入过量铁粉:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
B、硫酸氢钠溶液与足量氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
C、用FeCl3溶液腐蚀铜电路板:2Fe3++Cu=2Fe2++Cu2+
D、离子反应H++OH-=H2O能代表酸碱中和这一类反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com