
题目列表(包括答案和解析)
19.在1 LK2SO4和CuSO4的混合溶液中,c(SO42-)=2.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L(标况)气体,则原溶液中K+的物质的量浓度为 ( )
A.2.0 mol·L-1 B.1.5 mol·L-1
C.1.0mol·L-1 D.0.5 mol·L-1
18.某有机样品3.1 g完全燃烧,燃烧后的混合气体通入过量的澄清石灰水,石灰水共增重7.1g,经过滤得到l0 g沉淀。该有机样品可能是 ( )
A.乙烯 B.乙醛
C.乙酸 D.乙二醇
17.下表是X、Y、Z三种元素单质的某些性质:
|
元素 |
熔点/℃ |
沸点/℃ |
与水的反应 |
导电性 |
|
X |
一209.9 |
-195.8 |
不反应 |
不导电 |
|
Y |
一219.6 |
一188.1 |
形成酸性溶液 |
不导电 |
|
Z |
180.5 |
1347 |
形成碱性溶液 |
导电 |
若X、Y、Z这三种元素属于周期表中的同一周期,则它们的原子序数递增的顺序是
( )
A.X、Y、Z B.Z、X、Y
C.Y、X、Z D.Z、Y、X
16.一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2 X(g)+Y(g);=Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是( )
A.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
B.以X浓度变化表示的反应速率为0.00l mol/(L·s)
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则正反应的△H>0
15.Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是 ( )
A.Na2O2只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物[
C.O2是还原产物
D.2 mol FeSO4发生反应时,反应中共有8 mol电子转移
14.下列是某同学对相应的离子方程式所作的评价,其中评价合理的是 ( )
|
编号 |
化学反应 |
离子方程式 |
评 价 |
|
A |
碳酸钙与醋酸反应 |
CO32-+2CH3COOH=CO2↑+H2O+2CH3COO- |
错误,碳酸钙是弱电解质,不应写成离子形式 |
|
B |
苯酚钠溶液中通入CO2 |
2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
正确 |
|
C |
NaHSO3的水解 |
 HSO3-+H2O SO32-+H3O+ HSO3-+H2O SO32-+H3O+ |
错误,水解方程式误 写成电离方程式 |
|
D |
等物质的量的FeBr2和Cl2反应 |
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
错误,离子方程式中Fe2+与Br-的物质的量之比与化学式不符 |
12.等浓度的下列物质的水溶液,加热到80℃,忽略水的蒸发,溶液的pH不变的是( )
A.Na2CO3 B.NaOH C.Na2SO4 D.H2SO4
|
|
乙:H2C2O4·2H2O CO↑+CO2↑+3H2O为判断甲、乙何者正确,在②之后还需补做的实验为 ( )
A.再验证剩余气体是否可燃及燃烧时火焰的颜色
B.将剩余气体还原热的CuO粉末,观察固体颜色的变化
C.将剩余气体通入溴水中,看溴水是否褪色
D.将剩余气体干燥后燃烧,再用无水硫酸铜检验燃烧产物
11.下列各组离子可能大量共存的是 ( )
A.pH=1的溶液中:Fe2+、A13+、Cl-、MnO4-
B.能与金属铝反应放出氢气的溶液:K+、NO3-、Cl-、NH4+
C.能使酚酞试液变红的溶液中:Na+、Cl-、S2-、SO32-
D.含有大量H+的无色溶液中:Na+、Cu2+、A1O2-、SiO2-
10.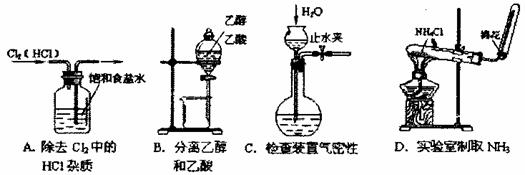 化学新教材中,常借助于图像,这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图像表现的内容正确的是 ( )
化学新教材中,常借助于图像,这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图像表现的内容正确的是 ( )
9.某原电池总反应为:Cu+2Fe3+ Cu2++2Fe2+,下列能实现该反应的原电池是( )
|
|
A |
B |
C |
D |
|
电极材料 |
Cu、Zn |
Cu、Ag |
Cu、C |
Fe、Zn |
|
电解液 |
FeCl3 |
Fe2(SO4)3 |
Fe(NO3)2 |
CuSO4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com