
题目列表(包括答案和解析)
4.某物质含有极性共价键,则该物质( )
A.可能含有离子键
B.可能是无机物或有机物
C.可能是单质或化合物
D.不可能是金属晶体

3.下列说法错误的是( )
A.常温下氨基酸都是晶体 
B.石油和煤都是烃类物质 
C.油酸是单不饱和高级脂肪酸
D.HNO3能与甘油、纤维素等在一定条件下发生反应

2.下列化学式代表的物质一定有固定沸点的是( )
A.C3H6 B.C2H4O2 C.CF2Cl2 D.C3H7OH

1.以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是( )
A. B.
B.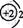 C.
C. D.
D.


21.铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3 → Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平,不考虑2NO2 N2O4)。(改编)
N2O4)。(改编)
 (1) 0.004molCu被硝酸完全溶解后,Cu失去的电子数是______________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是______________,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为____________。
(1) 0.004molCu被硝酸完全溶解后,Cu失去的电子数是______________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是______________,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为____________。
(2) 如果参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式_________________________________________________________。
答案:(1)0.008NA (答0.008mol不得分);0.012mol ;44.8mL ;
(2)3Cu + 10H++ 4 =
3Cu2++NO↑+3NO2↑+5H2O
=
3Cu2++NO↑+3NO2↑+5H2O
20. 甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如下图所示的转化关系。(原创)
甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如下图所示的转化关系。(原创)
(1)若甲、乙均为金属单质,则丁所属的物质类别是 。
(2)若甲为金属单质,乙为非金属单质,则丁可能
为 (填两种不同类别物质的化学式)。
(3)若甲、乙元素是同主族元素,根据元素周期表推测,
此时乙单质可能是 (填两种物质的化学式);
(4)若甲、乙元素是同周期元素,则该反应的化学方程式可能为 。
答案:考查中学常见的置换反应。
(1)氧化物;(2)MgO(Fe3O4)、NaOH(Ca(OH)2、KOH);(3)H2、Si
(4)2F2
+2H2O=4HF+O2(或2Mg+SO2 2MgO+S、2Mg+SiO2
2MgO+S、2Mg+SiO2 2MgO+Si)
2MgO+Si)
19.已知:①

+ (环己烯)
 ②CH2==CH-CH==CH2+Br2
CH2Br-CH==CH-CH2Br
②CH2==CH-CH==CH2+Br2
CH2Br-CH==CH-CH2Br
请利用已知反应方程式,回答下列问题:(改编)
(1)写出下列反应产物的结构简式:
H2C=CH-CH=CH-CH3+H2C=CH-CHO→ 。
(2)以某链烃A为起始原料合成化合物G的路径如下(图中Mr表示相对分子质量)

①指出反应类型B→C: ,F→G: 。
②写出下列物质的结构简式:
A: ,
F: 。
③写出下列反应的化学方程式:
B→C: ;
D→E: 。
④写出G与氢氧化钠溶液反应的方程式
。

 答案:(1)
答案:(1)
或

 (2)①水解反应(取代反应);加成反应;
(2)①水解反应(取代反应);加成反应;

②
; 或
 ③
③
 BrCH2-C(CH3)==CH-CH2Br+2NaOH
BrCH2-C(CH3)==CH-CH2Br+2NaOH
CH2(OH)-C(CH3)==CH-CH2(OH)+2NaBr;
HOOC-C(CH3)==CH-COOH+2CH3CH2OH
H5C2OOC-C(CH3)==CH-COOC2H5+2H2O

④
18、有A、B、C、D、E、F六种短周期元素,原子序数依次增大,其中C和E、B和D分别同主族, D、E、F同周期,C元素的原子序数是B和D元素原子的价电子数之和。C和E能形成两种常见的化合物;B能分别与A、E、F形成三种常见的重要溶剂。(原创)
(1)B、D、E、F四种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:___ ___ (用化学式表示)。
(2)B与A、E、F形成的三种溶剂分子的空间构型依次为 、 、 。
(3)B与D形成的固体属于 晶体,
答案:(1)HClO4>H2SO4>H2CO3>H4SiO4(3分)
(2)平面正六边型、直线型、正四面体型(3分)
(3)原子(2分)
17. 某研究性学习小组为验证在相同条件下,相同浓度的一元强酸和一元弱酸与同一种金属反应时,生成氢气的速率不同,同时测定该温度和压强下的气体摩尔体积,设计组装了两套如下图所示的简易实验装置。该实验的主要操作步骤如下:(改编)
某研究性学习小组为验证在相同条件下,相同浓度的一元强酸和一元弱酸与同一种金属反应时,生成氢气的速率不同,同时测定该温度和压强下的气体摩尔体积,设计组装了两套如下图所示的简易实验装置。该实验的主要操作步骤如下:(改编)
①配制浓度均为1.00 mol·L-1的盐酸和醋酸溶液各250mL;
②在量气管中装水并记录A的液面位置,按图示连接好装置,检查装置的气密性;
③分别量取10.00 mL 1.00mol·L-1的盐酸和醋酸溶液加入两套装置的大试管中;
④称取两份质量均为a g的镁带(已除去表面氧化膜且表面积相同),并固定于塑料杆末端;
⑤将塑料杆向下移动,使镁带同时浸入酸中至反应完全。
⑥反应结束后待温度恢复到室温,记录A的液面位置。
请根据上述步骤回答下列问题:
(1)下图所示仪器中,配制盐酸和醋酸溶液时必须用到的仪器是G和 (填序号)。


(2)量取10.00mL 1.00 mol·L-1盐酸和醋酸溶液分别注入锥形瓶中时,所用的仪器是
(填下列各项序号字母)
A.50mL量筒 B.10mL量筒
C.25 mL酸式滴定管 D.25 mL碱式滴定管
(3)步骤④中,理论上称取的镁带质量不能少于 g。
(4)步骤⑤中需记录的数据是 。
(5)步骤②、⑥中记录A的液面位置时,除视线平视外,还应_________________________。若测得氢气体积为V mL (已换算为标准状况,水蒸气的挥发影响忽略不计),则在该温度和压强下,气体摩尔体积为 L·mol-1。
答案:(1)bcde (2)C (3)0.12
(4)反应的起止时间; (5)使A和B的液面相平 (6)0.2V
16.某实验兴趣小组对NaHCO3饱和溶液的pH随温度的变化进行了测量,实验数据记录如下:(改编)
|
温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
(1)甲同学认为,NaHCO3饱和溶液pH升高的原因有两种可能:
①一是HCO3-的水解程度随温度升高而增大,故碱性增强,离子方程式为 ;
②二是 ;
(2)请你设计一个简单的实验以确定NaHCO3饱和溶液的pH随温度升高的原因,简述实验方法和结论:
答案:(1)①HCO3-+H2O H2CO3+OH-;
H2CO3+OH-;
②NaHCO3受热分解生成了更易水解的Na2CO3
(2)向加热煮沸的NaHCO3溶液中加入足量的BaCl2溶液,若产生白色沉淀,则是原因②;否则为原因①或者将加热后的溶液冷却到10℃,若溶液的pH=8.3,则为原因①;若溶液的pH>8.3,则为原因②。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com