
题目列表(包括答案和解析)
3.在碘酸钠( )的碱性溶液中通入氯气,可以得到高碘酸钠(
)的碱性溶液中通入氯气,可以得到高碘酸钠(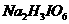 )。下列有关该反应的说法错误的是
)。下列有关该反应的说法错误的是
A.在该反应中碘酸钠作还原剂
B.碱性条件下,氯气的氧化性强于高碘酸钠
C.反应中生成1 mol 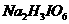 ,转移2mol电子
,转移2mol电子
 D.反应中氧化产物与还原产物的物质的量之比为2:1
D.反应中氧化产物与还原产物的物质的量之比为2:1
2.下列有关化学用语使用正确的是
A.醛基的电子式:
B.原子核内有8个中子的碳原子:
C.钾离子结构示意图: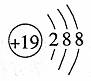
D,2-甲基一1一丙醇的结构简式: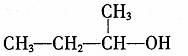
1.温家宝总理在2010年政府工作报告中提出:“要大力开发低碳技术,推广高效节能技术,积极发展新能源和可再生能源。”下列有关做法与此不相符的是
A.大力开发丰富的煤炭资源,减少对石油的依赖
B.回收废弃饮料包装纸,制作成公园内的休闲长椅
C.在西部和沿海地区兴建风力发电站,解决能源问题
D.鼓励购买小排量汽车,推广与发展电动、混合动力汽车
31.工业上利用焦炭在石灰窑中燃烧放热,使石灰石分解生产CO2。主要反应如下:
C+O2→CO2 ①, CaCO3→CO2↑+CaO ②
(1)含碳酸钙95%的石灰石2.0 t按②完全分解(设杂质不分解),可得标准状况下CO2的体积为_________________m3。
(2)纯净的CaCO3和焦炭按①②完全反应,当窑内配比率
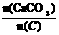 =2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
=2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
(3)某次窑气成分如下:O2 0.2%,CO 0.2%,CO2 41.6%,其余为N2。则此次窑内配比率 为何值?
为何值?
30.曾发生的液氯储罐爆炸,其原因是液氯中混有NCl3。当液氯中NCl3的质量分数达到4%以上就有爆炸危险。
(1)NCl3易水解生成一种碱性气体和一种具有漂白性的物质。写出该反应的化学方程式 。
(2)为测定氯气中的NCl3含量,将一定量样品先通过足量盐酸吸收NCl3 (反应为:NCl3+4HCl→NH4Cl+3Cl2),再用400mL20.0%(ρ=1.22g/cm3)的工业NaOH溶液吸收所有的Cl2,测得吸收后NaOH溶液增重51.4 g。经测定NCl3吸收管内NH4+质量为0.270 g。
①上述工业NaOH溶液的物质的量浓度为 。
② 计算该样品中NCl3的质量分数,并判断该样品是否安全?
29.有机物A (C8H13O2Br)有如下变化,其中只有B1既能使溴水褪色,又能和Na2CO3溶液反应生成CO2。
|
|
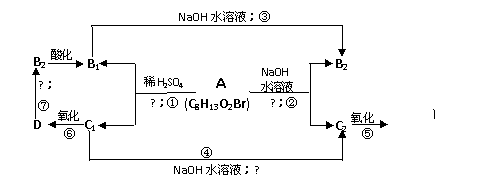

(1)C1中含有的官能团有__________(写名称)。
(2)反应类型:①______________;③___________________。
(3)写出A、C2的结构简式:
A___________________________________C2________________________________。
(4)写出反应②的化学方程式:
_______________________________________________________________。
(5)已知CH2=CH-OH不稳定,写出B1既可以发生银镜反应,又可以与金属钠发生反应的所有链状同分异构体的结构简式:
______________________________________________________________。
28.有机物X的结构用键线式表示为 。
(1)X分子式为 ,X与H2完全加成生成Y,Y一氯代物有 种。
(2)有机物Z1、Z2、Z3都是X的同分异构体。其中Z1、Z3属于芳香烃。
①Zl只有一个侧链,写出任意一种Z1的结构简式 。
②Z2分子中只有C-C单键和C-H单键,其结构简式为 。
Z1、Z2均一定能发生的反应类型有 (选填序号)。
a.加成 b.取代 c.氧化 d.消去
③写出Z3(有二个取代基)与乙烯以等物质的量在一定条件下反应生成聚合物的化学方程式:
27.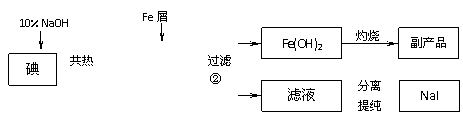 碘化钠是常用的分析试剂,还用于医疗、照相业。工业上用铁屑还原法制备NaI,其主要流程如下,请回答问题:
碘化钠是常用的分析试剂,还用于医疗、照相业。工业上用铁屑还原法制备NaI,其主要流程如下,请回答问题:


已知:NaI易被空气氧化;反应②为:3Fe + IO3-+ 3H2O → 3Fe (OH)2 ↓ +I-
(1)实验室灼烧Fe(OH)2主要在 进行(填仪器名称);灼烧后的副产品是 (写化学式)。
(2)判断①中碘单质是否完全反应的实验方法是
;
(3)实验室配制一定量10%NaOH溶液,其操作步骤是 。
(4)测定产品中NaI含量的方法是:
a.称取3.000 g样品、溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.1000 mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为19.00 mL。
①测定过程所需仪器在使用前需要检查是否漏液的有 。
② 该样品中NaI的质量分数为 。
③ 若测定结果偏低,试分析可能的原因(任写两条):
、 。
26.现用如图所示的装置制取较多量的饱和
氯水并测定饱和氯水的pH。
回答有关问题:
(1)写出有关化学方程式。
装置甲:________________________________________________;
装置丁: __________________ 。
(2)证明氯水已饱和的现象是 。
(3)制取结束时,装置丙的液体中含有最多的微粒是 (用微粒符号表示,下同);装置乙的液体中存在的微粒有 。
 (4)有如下改进措施或建议,请作出评价:
(4)有如下改进措施或建议,请作出评价:
①在装置乙和丙之间增加如图(a)所示的装置,
你认为有无必要? 。
②在装置丙的长导管下口处,接如图(b)所示的
多孔球泡,这样做的好处是:
。
③若撤去装置乙,直接将装置甲和丙相连。这样做对实验结果的影响是:
。
0.4mol的N2和1.2mol的H2,在一
定条件下发生如下反应:
N2(g)+3H2(g) 2NH3(g)+Q(Q>0)。
2NH3(g)+Q(Q>0)。
反应中NH3的物质的量浓度随时间的变化
情况如图:
(1)从反应开始到平衡时,平均反应速率v(NH3)为_______________。
(2)若改变某一条件使平衡向正反应方向移动,则v(正) (选填序号,下同)。
a.不变 b.减小 c.增大 d.均有可能
(3)下列各项能够说明反应达到平衡的是___________。
a.n(N2)和n(H2)之比保持不变 b.容器内的压强保持恒定不变
c.n(NH3)和n(N2)之比保持不变 d.容器中物质的总质量保持不变
(4)第5min,若改变反应温度,则NH3的浓度不可能为 mol·L-1。
a. 0.40 b.0.12 c.0.10 d.0.08
(5)在第5min将容器压缩一半体积,若在第8min达到新的平衡(NH3的浓度约为0.25 mol·L-1),请在上图中画出第5-9分钟内NH3浓度的近似变化曲线。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com