
题目列表(包括答案和解析)
3.对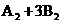

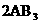 反应来说,以下反应速度的表示,最快的是( )
反应来说,以下反应速度的表示,最快的是( )
A. B.
B.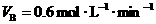
C. D.无法判断
D.无法判断
2.下列四种x的溶液,分别加入盛有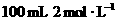 盐酸的烧杯中,并加入水稀释至500mL,此时x和盐酸缓和地进行反应,其中反应速率最大的是( )
盐酸的烧杯中,并加入水稀释至500mL,此时x和盐酸缓和地进行反应,其中反应速率最大的是( )
A.20 mL,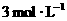 B.20 mL,
B.20 mL,
C.10 mL,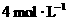 D.10 mL,
D.10 mL,
1.对于反应2A(g)+3B(g)=C(g)+5D(g),在某段时间内的平均反应速率为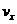 ,(x代表某反应物或生成物)之间的关系,正确的是( )
,(x代表某反应物或生成物)之间的关系,正确的是( )
A.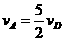 B.
B.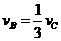 C.
C.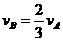 D.
D.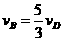
2. 受两个变量(P、T)影响的图像:分析依据“定一议二”。转化率或百分含量等因素受到压强、温度两个变量的影响,先确定一个变量,分析另外两个量的关系。如确定温度分析转化率受压强的影响。
受两个变量(P、T)影响的图像:分析依据“定一议二”。转化率或百分含量等因素受到压强、温度两个变量的影响,先确定一个变量,分析另外两个量的关系。如确定温度分析转化率受压强的影响。
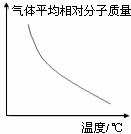
[练习13]可逆反应2A+B 2C(g) △H<0,随温度变化气体平均相对分子质量如图所示,则下列叙述正确的是( )
2C(g) △H<0,随温度变化气体平均相对分子质量如图所示,则下列叙述正确的是( )
A.A和B可能都是固体 B.A和B一定都是气体
C.若B为固体,则A一定是气体
D.A和B可能都是气体
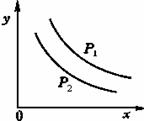 [练习14]反应L(s)+aG(g)
[练习14]反应L(s)+aG(g)
 bR(g)达到平衡时,温度和压强对该反应的影响如图所示。图中,压强p1>p2, x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )
bR(g)达到平衡时,温度和压强对该反应的影响如图所示。图中,压强p1>p2, x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )
A.上述反应是放热反应 B.上述反应是吸热反应
C. a>b D. a<b
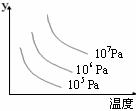 [练习15]某可逆反应L(s) + G(g)
[练习15]某可逆反应L(s) + G(g)  3R(g) ΔH>0,右图表示外界条件温度压强的变化对上述反应的影响。试判断图中Y轴可以表示( )
3R(g) ΔH>0,右图表示外界条件温度压强的变化对上述反应的影响。试判断图中Y轴可以表示( )
A.平衡混合气中R的质量分数
B.达到平衡时G的转化率
C.平衡混合气中G的质量分数
D.达到平衡时L的转化率
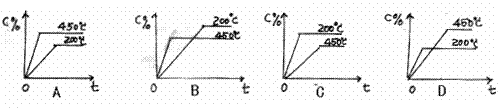
[练习16]反应mA(s)
+ nB(g)  eC(g) + fD(g)反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是( )
eC(g) + fD(g)反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是( )
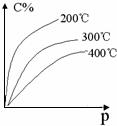 A.达到平衡后,加入催化剂,则C%增大
A.达到平衡后,加入催化剂,则C%增大
B.达到平衡后,若升温,平衡左移
C.化学方程式中n>e +f
D.达到平衡后,增加A的量有利于平衡右移
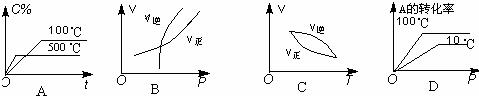 [练习17]如图所示,可逆反应:2A(g)+B(g)
[练习17]如图所示,可逆反应:2A(g)+B(g)  2C(g) △H<0的图像正确的是( )
2C(g) △H<0的图像正确的是( )
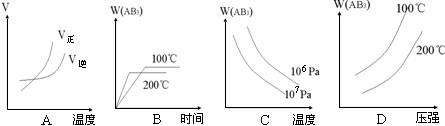
[练习18]对于可逆反应,A2(g)+3B2(g)  2AB3(g)△H<0,下列图像不正确的是( )
2AB3(g)△H<0,下列图像不正确的是( )
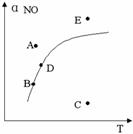 [练习19]在其它条件一定时,图中曲线表示反应
[练习19]在其它条件一定时,图中曲线表示反应
2NO(g)+ O2(g)  2NO2(g) △H>0达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且V正>V逆的点是( )
2NO2(g) △H>0达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且V正>V逆的点是( )
A.A或E B.B点
C.C点 D.D点
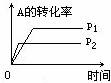
 [练习20]反应A2+B2
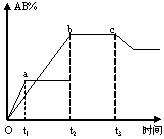
[练习20]反应A2+B2 2AB在不同条件下,产物AB百分含量随时间变化关系如图所示,a为500℃,b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是( )
2AB在不同条件下,产物AB百分含量随时间变化关系如图所示,a为500℃,b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是( )
A.A2、B2、AB均为气体,正反应放热
B.AB为气体,A2、B2中最少有一种为非气体,正反应放热
C.AB为气体,A2、B2中最少有一种为非气体,正反应吸热
D.AB为固体,A2、B2中最少有一种为非气体,正反应吸热
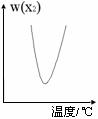 [练习21]两种气态单质按下列反应
[练习21]两种气态单质按下列反应
X2(g) + Y2(g)
 2XY(g),X2与Y2按一定比例混合,在不同温度下经一定时间反应,混合物中X2的体积分数变化如图所示,试确定该反应是吸热反应还是放热反应
2XY(g),X2与Y2按一定比例混合,在不同温度下经一定时间反应,混合物中X2的体积分数变化如图所示,试确定该反应是吸热反应还是放热反应
1. 出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂)。
出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂)。
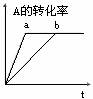
[练习7]已知某可逆反应在密闭容器中进行:
A(g)+2B(g)  3C(g)+D(s) △H<0,图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是(
)
3C(g)+D(s) △H<0,图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是(
)
A.增大A的浓度 B.缩小容器的容积
 C.加入催化剂
D.升高温度
C.加入催化剂
D.升高温度
[练习8]现有可逆反应A(g)+2B(g) 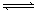 nC(g) △H<0,在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如右图,其中结论正确的是( )
nC(g) △H<0,在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如右图,其中结论正确的是( )
 A.p1>p2,n>3 B.p1<p2,n>3
C.p1<p2,n<3 D.p1>p2,n=3
A.p1>p2,n>3 B.p1<p2,n>3
C.p1<p2,n<3 D.p1>p2,n=3
[练习9]对于可逆反应A(g)+B(g)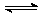 C(g) △H<0,下列图像正确的是( )
C(g) △H<0,下列图像正确的是( )
[练习10]可逆反应:aA(g)+
bB(g)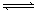 cC(g)+ dD(g)
cC(g)+ dD(g)
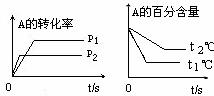 根据图回答:
根据图回答:
①压强 P1比P2 (填大或小) ;
②(a +b)比(c +d) (填大或小);
③温度t1℃比t2℃ (填高或低);
④正反应 热(填吸或放)。
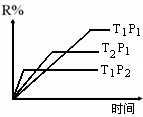 [练习11]在密闭容器中进行下列反应:
[练习11]在密闭容器中进行下列反应:
M(g)
+ N(g)  R(g) +
2L,此反应符合右图,下列叙述正确的是( )
R(g) +
2L,此反应符合右图,下列叙述正确的是( )
A.正反应吸热 ,L是气体
B.正反应吸热, L是固体
C.正反应放热 ,L是气体
D.正反应放热 ,L是固体或液体
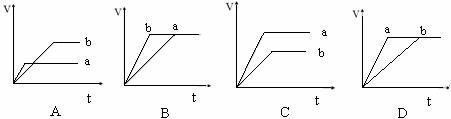
[练习12]等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气的总体积(V)与时间的关系正确的是( )
2.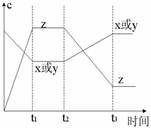 c-t图像:分清反应物和生成物,浓度减小的为反应物,浓度增大的为生成物,分清消耗浓度和增加浓度,反应物的消耗浓度和生成物的增加浓度之比,等于化学方程式中各物质的化学计量数之比。
c-t图像:分清反应物和生成物,浓度减小的为反应物,浓度增大的为生成物,分清消耗浓度和增加浓度,反应物的消耗浓度和生成物的增加浓度之比,等于化学方程式中各物质的化学计量数之比。
[练习5]今有X(g)+Y(g)
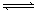 2Z(g) △H<0。从反应
2Z(g) △H<0。从反应
开始经过t1后达到平衡状态,t2 时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是( )
A.增大X或Y的浓度 B.增大压强
C.增大Z的浓度 D.升高温度
 [练习6]右图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间。试回答:
[练习6]右图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间。试回答:
(1)该反应的反应物是______;
(2)反应物的转化率是______;
(3)该反应的化学方程式为___________________________。
13.电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。有关反应为:2FeCl3+Cu=2FeCl2+CuCl2。
现将一块敷有铜箔的绝缘板浸入8.00×102mL某FeCl3溶液A中,一段时间后,将该线路板取出,向所得的溶液B中加入铁粉mg,充分反应后剩余固体质量为ng,把固体滤出并从滤液C(忽略反应前后溶液体积的变化)中取出20.00mL,向其中滴入3.00mol·L-1AgNO3溶液60.00mL时,溶液中的Cl-恰好完全沉淀。
(1)溶液A中FeCl3的物质的量浓度为__________。
(2)假若铁粉不再溶解,向溶液B中加入的铁粉质量至少应该大于_______________。
(3)讨论当剩余固体的组成不同时,m与n可能的取值范围,并填入下表:

(4)当m=100.0,n=96.8时,溶液B中FeCl2的物质的量浓度为____________。
12.A-I分别表示中学化学中常见的一种物质,它们之间的相互转化关系如下图所示(部分反应物,生成物从略):
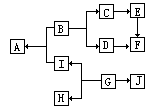
已知:A、B、C、D、E、F六种物质中均含同一种元素;G为主族元素的固态氧化物。
(1)写出下列物质的化学式:E______、F______、J______。
(2)写出有关反应的化学方程式:
①_____________________________________
②_____________________________________
③_____________________________________
11.用金属钠制取氧化钠,通常采用以下方法:2NaNO3+10Na  6Na2O+N2↑。试说明为什么不采用钠在氧气中燃烧而采用这种方法来制取氧化钠的原因:_______________________________________________________________________________。
6Na2O+N2↑。试说明为什么不采用钠在氧气中燃烧而采用这种方法来制取氧化钠的原因:_______________________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com