
题目列表(包括答案和解析)
19.(12分)重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产。实验室模拟工业生产如下图:

涉及的主要反应为:6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4 +3Fe2O3+7KCl+12H2O
12Na2CrO4 +3Fe2O3+7KCl+12H2O
在反应器中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐。氧化铝与碳酸钠发生的反应为Al2O3 + Na2CO3 2NaAlO2 +CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O
2NaAlO2 +CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O NaAl(OH)4
NaAl(OH)4 Al(OH)3+NaOH。
Al(OH)3+NaOH。
(1)写出二氧化硅与碳酸钠反应的化学方程式 。
(2)NaFeO2能强烈水解,在操作②中生成沉淀而除去,试写出该反应的化学方程式:
。
(3)操作③调节后溶液的pH比原来降低,调节的目的是(用简要的文字和必要的离子方
程式说明)
。
(4)称取重铬酸钾(K2Cr2O7式量为294)试样m g配成VmL溶液,取出V1 mL于锥形瓶中,加入适量的稀H2SO4和足量碘化钾,放于暗处5min,然后加入100mL水,同时加入3mL淀粉溶液作指示剂,用c mol•L-1Na2S2O3标准溶液滴定(相关反应为:
Cr2O72-+6I-+14H+= 2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- )。则:
①取V1 mL待测液应选用的仪器为 (写仪器名称)。
②判断达到滴定终点的依据是 。
③设整个过程中其它杂质不参与反应。若实验中共用去Na2S2O3标准溶液V2mL,则计算所得产品中重铬酸钾纯度的代数式为 (不必化简)。
0.4mol的N2和1.2mol的H2,在一定条件下发生如下反
应:N2(g)+3H2(g) 2NH3(g)
△H<0,5min时达到平衡,
2NH3(g)
△H<0,5min时达到平衡,
反应中NH3的物质的量浓度的变化情况如右图所示:
请回答下列问题:
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)= 。
(2)该反应的化学平衡常数表达式为 。
(3)反应达到平衡后,第5min末保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 (填序号)
a. 0.82mol•L-1 b. 0.25mol•L-1 c. 0.20mol•L-1 d. 0.08mol•L-1
(4)反应达到平衡后,第5min末保持其他条件不变,若只把容器的体积缩小一半,平衡
移动(填“向右”、“向左”或“不”),化学平衡常数 (填“增大”、“减少”或“不变”)。
(5) 其它条件不变,在第5min末将容器的体积缩小一半,若第8min达到新的平衡(此时NH3的物质的量约为0.25mol),请在上图中画出第5min末到此平衡时NH3物质的量浓度的变化曲线。
18. (10分)某温度时,在一容积为1L的密闭容器中,加入
(10分)某温度时,在一容积为1L的密闭容器中,加入
16. 已知25℃时,AgI饱和溶液中c(Ag+)为1.23×10-8 mol·L-1,AgCl的饱和溶液中c(Ag+)
为1.25×10-5 mol·L-1。若在5mL含有KCl和KI各为0.01 mol·L-1的溶液中,加入8mL
15.下列各溶液中,微粒的物质的量浓度关系正确的是
A.0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c (OH-)
B.0.1mol·L-1的NaHCO3溶液中:c(Na+) = c(HCO3-) + c(H2CO3)+ 2c(CO32-)
C.0.1mol·L-1的NH4Cl溶液与0.05mol·L-1的NaOH溶液等体积混合:
c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c( NH4Cl)
14.用CH4催化还原 NOx可以消除氮氧化物的污染。例如:
① CH4(g)+4NO2(g)=4NO(g)+ CO2(g) + 2H2O(g) △H=-574kJ·mol-1
② CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol一1
下列说法不正确的是
A.若用标准状况下 4.48LCH4 还原 NO2生成N2和水蒸气,放出的热量为 173.4kJ
B.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H >-574 kJ·mol-1
C.反应 ①② 转移的电子数相同
D.反应 ②中当4.48LCH4 反应完全时转移的电子总数为1.60 mol
12.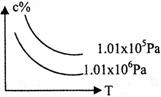 在一定条件下,对于反应mA(g)+nB(g)
在一定条件下,对于反应mA(g)+nB(g)  cC(g)+dD(g),
cC(g)+dD(g),
C物质的含量(c%)与温度、压强的关系如图所示,下列判断
正确的是
A.△H<0 m+n<c+d B.△H>0 m+n>c+d
C.△H>0 m+n<c+d D.△H<0 m+n>c+d
科网13.肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%-30%的KOH溶液。电池总反应为:N2H4+O2=N2+2H2O。下列关于该燃料电池工作时的说法正确的是
A.负极的电极反应式是:N2H4+4OH-→4H2O+N2↑+4e-
B.正极的电极反应式是:O2+4H++4e-→2H2O
C.溶液中阴离子向正极移动
D.电解后电解质溶液的碱性增强
11.海水是一个巨大的化学资源库,下列有关海水综合利用的说法不正确的是
A.在苦卤中加石灰乳过滤得沉淀,然后加盐酸,经浓缩、结晶、脱水、电解可以得到金属镁
B.从海水中可得到NaCl,电解熔融NaCl或其水溶液都可制得Cl2
C.利用蒸馏原理从海水中提取淡水是海水淡化技术发展的新方向
D.将苦卤浓缩、氧化,鼓入热空气或水蒸气可提取溴
10.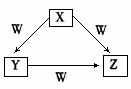 X、Y、Z、W是中学化学常见的四种物质,他们之间具有如图所示转化关系,则下列组合不可能的是
X、Y、Z、W是中学化学常见的四种物质,他们之间具有如图所示转化关系,则下列组合不可能的是
|
|
X |
Y |
Z |
W |
|
A |
C |
CO |
CO2 |
O2 |
|
B |
Na |
Na2O |
Na2O2 |
O2 |
|
C |
AlCl3 |
Al(OH)3 |
NaAl(OH)4 |
NaOH |
|
D |
Fe |
FeCl2 |
FeCl3 |
Cl2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com