
题目列表(包括答案和解析)
5.下列事实与胶体性质无关的是 ( )
A.水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
B.将植物油倒入水中用力搅拌形成油水混合物
C.一束平行光线射入蛋白质溶液里,从侧面可以看到一条光亮的通路
D.氢氧化铁胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解
4.氢化锂(LiH)、氘化锂(LiD)、氚化锂、(LiT)在一定条件下都可产生极高的能量,被广泛应用在火箭推进剂和核反应中。下列有关说法中,正确的是 ( )
A.LiH、LiD、LiT是同一种物质
B.LiH、LiD、LiT中氢元素的合化价均为+1价
C.H、D、T之间互称为同位素
D. LiH、LiD、LiT在反应中常做氧化剂
3.下列说法中,不正确的是 ( )
A.化学的主要特点是原子、分子水平上认识物质,化学可以识别、改变和创造分子
B.学习化学的基本方法有观察法、实验法、分类法、比较法等
C.化学反应的过程中除了伴随着物质的变化还必然伴随着能量的变化
D.元素的性质随着元素相对原子质量的递增而呈现周期性变化
1.联合国气候变化大会于2009年1 2月7日-18日在丹麦首都哥本哈根召开,焦点议题之一是发展“低碳经济”,减少温室气体排放。你认为下列做法中.不能有效减少空气中CO2含量的是 ( )
A.开发利用太阳能、风能、生物能、海洋能等清洁能源
B.使用节能产品,推广节能环保汽车
C.植树造林,增加森林植被面积
D.用脱硫处理的煤代替原煤作燃料
 2.下列说法中.正确的是 ( )
2.下列说法中.正确的是 ( )
A.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
B.难溶于水的电解质一定是弱电解质
C.离子化合物中可能含有共价键
D.由同种元素组成的物质一定属于纯净物
33.(8分)(化学一有机化学基础)
分子式为C12H14O2的有机物F广泛用于制备香精的调香剂。为了合成该有机物,某实验室的科技人员设计了下列合成路线。

试回答下列问题:
(1)若A物质与H:发生加成反应,产物的名称为 ;
(2)合成路线中反应⑥所属反应类型名称为 ;
(3)反应④的化学方程式为 ;
(4)按要求写出E的一种同分异构体的结构简式: 。
要求:①属于芳香族化合物。②遇浓溴水不能产生白色沉淀。
32.(8分)(化学一物质结构与性质)
A、T、X、Y、z是中学化学常见的四种元素,原子序数依次增大,其结构或性质信息如下表:
|
元素 |
结构或性质信息 |
|
T |
基态原子的L层上s电子数等于p电子数 |
|
X |
基态原子最外层未成对电子数在该元素所在周期中最多 |
|
Y |
基态原子的第一电离能在该元素所在周期中最小 |
|
Z |
单质常温、常压下是气体。基态原子的M层上有1个未成对的p电子 |
请根据信息回答有关问题(答题时如需表示具体元素,请用相应的元素符号):
(1)T、X、Z三种元素的电负性由大到小的顺序是 。
(2)写出与x单质分子互为等电子体的物质的化学式 、 。
(分子、离子各一种)
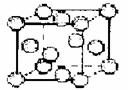 (3)元素Q的原子序数是Y与Z的原子序数之和。
(3)元素Q的原子序数是Y与Z的原子序数之和。
①元素Q与元素T、x能形成平面型的[Q(TX)4]2-离子。
TX-中T原子采用的轨道杂化方式是 。
②Q单质的晶胞如右图甲所示,Q单质中Q原子的配位数为
。
31.(8分)(化学一化学与技术)
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
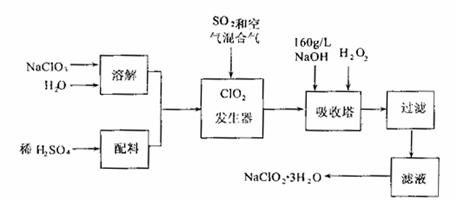
已知:①NaClO2:的溶解度随温度升高而增大,适当条件下可结晶析出NaCIO2·3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
(1)发生器中鼓入空气的作用可能是 。
(2)吸收塔内发生反应的化学方程式为 。
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断Na0H是否过量的简单实验方法是 。
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是
30.(12分)I、某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
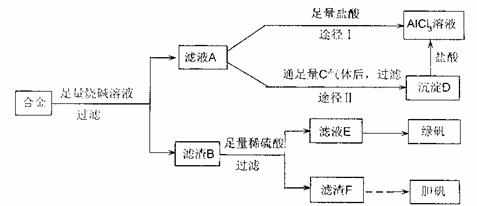
试回答下列问题:
(1)由滤液A制得AlCl3,溶液有途径I和Ⅱ两条,选择其中的合理途径的理由是:
。
(2)从经济效益和环境保护角度考虑,用滤渣F制备胆矾溶液的化学方程式:
。
Ⅱ、某校化学研究性学习小组,在学习金属的冶炼以后,对一氧化碳还原金属氧化物的实验非常感兴趣,他们查阅有关资料后分析:
(1)学生对相关装置进行分析和比较发现这些装置既有各自的优点,同时也发现各个装
置中均存在一些不足,具体看下表:
|
人教版、广东版、山东版 |
上海科学技术出版社 |
2005(7-8)化学教学杂志 |
||
|
|
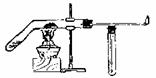
(2)在上述实验的基础上某学生设计了一氧化碳还原氧化铁相对更为合理的实验,重点
避免了上述三个不足。其中一氧化碳是利用甲酸和浓硫酸共热到60-80℃可发生脱水反应得到:

HCOOH CO↑+H2O
请根据以下各装置进行选择组成-套相对较为合理的实验装置图(某些装置可重复使用)
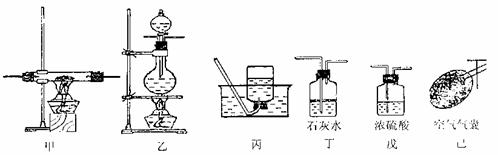
(3)回答以下问题:
①该实验装置合理的连接顺序是:己→乙→ → → → 丙
②在反应时先产生一氧化碳气体,过一会再点燃加热氧化铁的酒精灯,原因是
(填选项,多选扣分)
A.因为一般反应从左到右进行
B.排除体系内的空气,使反应过程更安全 .
C.甲酸与浓硫酸反应可以产生大量的CO气体
D.此反应加热时间长有利于产生CO
③观察到硬质玻璃管中红棕色粉末变为黑色时停止加热,然后继续 ,以防止铁被氧化。
④硬质玻璃管中发生反应的化学方程式是 。
29.(14分)下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,回答下列问题:
 族
族周期 |
I A |
ⅡA |
ⅢA |
ⅣA |
VA |
ⅥA |
ⅦA |
0 |
|
一 |
① |
|
||||||
|
二 |
|
|
|
② |
③ |
④ |
|
|
|
三 |
⑤ |
|
⑥ |
⑦ |
|
⑧ |
|
|
(1)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 (写化学式)。
(2)由表中元素可以组成多种漂白剂,试写出其中两种常用漂白剂的化学式: 、
。
(3)①、④、⑤三种元素形成的化合物中化学键的类型: 。
(4)②和④形成的化合物与④和⑤形成的化合物之间发生氧化还原反应,写出该反应的
化学方程式: 。
 (5)由表中元素形成的常见物质X、Y、Z、M、W可发生以下反应:
(5)由表中元素形成的常见物质X、Y、Z、M、W可发生以下反应:
①X溶液与Y溶液反应的离子方程式为 ;
②已知M为硝酸盐,则M溶液中各离子浓度由大到小排列顺序为:c( )>c( )>c( )>c( )(在括号内填离子符号)。
28.(16分)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成是目前普遍
 使用的人工固氮方法:N2(g)+3H2(g)
2NH3(g)。请回答:
使用的人工固氮方法:N2(g)+3H2(g)
2NH3(g)。请回答:
 (1)已知:H-H键能为436kJ/mol,NN键能为945kJ/mol,
(1)已知:H-H键能为436kJ/mol,NN键能为945kJ/mol,
N一H键。能为391kJ/mol。由键能计算消耗1molN:时
的△H= 。
(2)在一定条件下,将lmolN2与3molH2混合于一个10L密闭容。
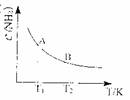
器中,反应达到 平衡时,混合气体中氨占25%,试回答:
平衡时,混合气体中氨占25%,试回答:
①N2的转化率d^为--。
 ②右图中:在状态A时,平衡常数KA
(代入数
②右图中:在状态A时,平衡常数KA
(代入数
值的表达式,不要求算出具体数值);当温度由T,变化到T2
时, KA KB(填“>”、“<”或“=”)。
(3)在1998年希腊亚里斯多德大学的Marmellos和Stoukides采
用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压
下高转化率的电化学合成氨,其实验装置如右下图,则正
极A的电极反应式为: 。
(4)某化肥厂生产铵态氮肥(NH4)2SO4的工艺流程如下:

向沉淀池中加入CaSO4悬浊液后,需先通入足量NH3,再通入适量CO2的原因是
;操作I的名称是 ;生产流程中能被循环利用的物质x为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com