
题目列表(包括答案和解析)
2.下列涉及有机物的性质或应用的说法,不正确的是: ( )
A.煤干馆可以得到甲烷、苯和氨等重要化工原料
B.液化石油气和天然气的主要成分都是甲烷
 C石油的催化裂化是为了提高汽油等轻质燃油的产量和质量
C石油的催化裂化是为了提高汽油等轻质燃油的产量和质量
D.粮食酿的酒在一定条件下密封保存一定时间会更香醇
1.2009年哥本哈根气候大会,被称作"人类拯救地球最后一次机会"的联合国气候变化大会。下列措施有利于节能减排、改善环境质量的是: ( )
①发展低碳经济、循环经济,开发推广太阳能、水能、风能等能源,可减少煤、石油等化石燃料的使用
 ②积极推行"限塑令",加快研发利用二氧化碳合成的聚碳酸醋类可降解塑料
②积极推行"限塑令",加快研发利用二氧化碳合成的聚碳酸醋类可降解塑料
③研制开发新型燃料电池汽车,减少机动车尾气污染
④推广使用燃煤脱硫技术,防治SO2污染
⑤使用填埋法处理未经分类的生活垃圾
A.①②④⑤B.①②⑤C.①②③④.D.③④⑤
33.(8分)[化学一有机化学基础]
X是一种能与FeCl3溶液作用显紫色的重要有机物。
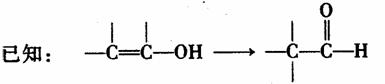
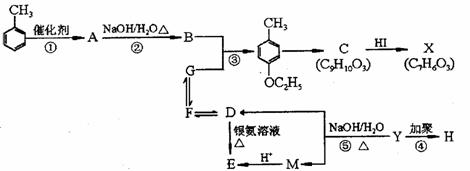
(1)写出E中官能团的名称 ,反应②的反应类型是 。
(2)X的结构简式为 。
(3)写出反应⑤的化学 。
(4)写出满足能与FeCl3溶液发生显色反应且含有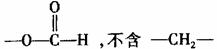 的
的
C(C9H10O3)的同分异构体的结构简式 (写出两种:一种苯环上有四个取代基,一种苯环上有两个取代基)。
32.(8分)[化学-物质结构与性质]
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题。
(1)C、Si、N元素的电负性由大到小的顺序是 。
C60和金刚石都是碳的同素异形体,二者相比较熔点高的是
(2)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
932 |
1821 |
15390 |
21771 |
|
B |
738 |
1451 |
7733 |
10540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色;为d1-d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+ 颜色(填“无”或“有”)。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为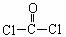 ,每个COCl2分子内含有
个δ键,
,每个COCl2分子内含有
个δ键,
个π键。其中心原子采取 杂化轨道方式。
A.4个δ键 B.2个δ键、2个π键
C.2个δ键、l个π键 D.3个δ仃键、l个π键
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5 == Fe(s) + 5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是 。
31.(8分)[化学-化学与技术]
粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。在实验室条件下以硫酸铜溶液为电解液,用电解的方法对粗铜提纯,并对阳极泥和电解液中金属进行回收和含量测定。回答以下问题;
(1)步骤一:电解精制:电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)。
步骤二:电解完成后,对电解液进行处理。
(2)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
|
序号 |
反应 |
平衡常数 |
|
1 |
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
|
2 |
Au3+ + 4Cl- = AuCl4- |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比l:3的混合物).请你简要解释金能够溶于王水的原因 。
(3)电解液含量的测定:下图是该小组探究电解液的一个实验流程:
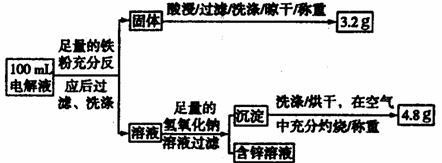
则100mL滤液中Cu2+ 的浓度为 mol·L-1 ,Fe2+的浓度为 mol·L-1
30.(17分)
(1)右图所示是实验室中制取气体的一种简易装置。
①请简述检验它的气密性的方法 。
②利用右图所示装置可以制取 气体(填反应
物状况及发生反应是否需要的条件)。
(2)张明同学设计下图所示装置,用粗铁粒与189g·L-1
硝酸反应制取NO气体。请回答有关问题。

①189g·L-1硝酸的物质的量浓度为 。
②NO气体能用排水法收集,而不能用排空气法收集的可能原因是 。
③当找末止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是 。B装置烧杯中液体的作用是 。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
④该实验中,若去掉B装置,对实验结果是否有影响? 。
⑤将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是 (用含a和b的代数式表示)。
⑥完全反应后,A装置烧杯里含铁的价态可能是 。现有仪器和药品:试管和胶头滴管。0.1mol·L-1KSCN溶液、0.1mol·L-1KI溶液、0.2mol·L-1酸性KMnO4溶液、氯水等。请你设计一个简单实验,探究上述判断,填写下列实验报告:
|
实验步骤 |
操作 |
现象与结论 |
|
第一步 |
取少量液体装于试管,向试管中滴入几滴KSCN溶液 |
|
|
第二步 |
|
若溶液紫色退去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
[选做部分]
29.(14分)
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义。
(1)在光照条件下,氯气和氢气反应过程如下:
①Cl2→Cl+Cl ②Cl+H2→HCl+H ③H+Cl2→HCl+Cl
反应②中被破坏的化学键是--,氯元素的原子结构示意图为--。。
(2)二氧化氯(ClO2)是一种广泛用于水处理消毒剂,与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有害的有机氯化物。制备ClO2的方法有以下两种:
2NaClO3+4HCl===2ClO2↑+Cl2+2NaCl+2H2O…………………………①
2NaClO2+H2O2+H2SO4===2C1O2↑+O2↑+Na2SO4+2H2O …………………②
你认为哪种方法最佳 (填序号),理由是 。
(3)工业上用电解饱和食盐水的方法制取烧碱和氯气,请写出反应的离子方程式
。
(4)碘钨灯具有比白炽灯寿命长且环保节能的特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:
W(s)+I2(g)
 WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中, 加热使其反应。
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中, 加热使其反应。
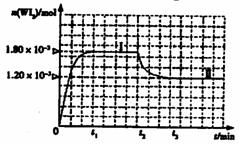 如图是WI2(g)的物质的量随时间变
如图是WI2(g)的物质的量随时间变
化关系图象,其中曲线I(0~t2时间段)
的反应温度为T1,曲线II(从t2开始)
的反应温度为T2,且T2>T1。
则:①该反应的△H 0(填“大于”
或“等于”或“小于”)
②从反应开始到t1时间内的平均反应速率
v(I2)= 。
③下列说法中不正确的是 (填序号)。
A.该反应的平衡常数表达式是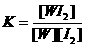
B.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(5)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是 ,溶液中离子浓度由大到小的顺序是
[不考虑H+和OH-。25℃时KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17]。
 请写出Mg与液态TiCl4反应提纯钛的热化学方程式
。
请写出Mg与液态TiCl4反应提纯钛的热化学方程式
。
(6)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl(g)==MgCl2(s)△H=-641kJ/mol
②Ti(s)+2Cl2(g)===TiCl2(l) △H=-770kJ/mol
28.(11分)
“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义。请你回答以下问题:
(1)无机非金属材料。高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
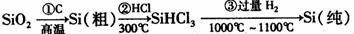
①写出步骤①的化学方程式 。
②步骤②经过冷凝得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3的主要化学操作的名称是 ;SiHCl3和SiCl4一样遇水可发生剧烈水解,已知SiHCl3水解会生成两种气态产物,请写出其水解的化学方程式 。
③请写出二氧化硅与氢氟酸反应的化学方程式 。
(2)磁性材料。这种材料一般含有铁元素,铁是用途最为广泛的金属,也较为活泼,所以从它的使用开始就不断实施着对它的防护。最常见的铁制品腐蚀就是电化学腐蚀,请出最为普遍的电化学腐蚀的负极反应式 。
(3)激光材料。我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料,它是一种两性氧化物,请用离子方程式加以说明:
, 。
(4)纳米材料。胶体是一种物质以“纳米”颗粒的形式分散到另一种物质里形成的分散系,胶体粒子的直经大约是 ,三氯化铁溶液可以加速伤口止血,请简述原因 。
(5)高分子材料。可以分成无机高分子材料和有机高分子材料。一种新型高效净水剂
[AlFe(OH)nCl6-n]m就属于无机高分子材料,广泛应用于生活用水和工业污水处理,其中铁元素的化合价为 。
一种合成纤维腈纶,又称“人造羊毛”,由丙烯腈(CH2=CH-CN)为原料聚合生成,请写出生成该有机高分子材料的化学方程式 。
15.下列判断正确的是 ( )
A.在稀氨水中加水稀释,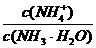 会增大
会增大
B.若酸性HA>HB,则等物质的量浓度等体积的NaA和NaB溶液混合有关系:
c(OH-)>c(A-)>c(B-)>c(H+)
C.0.1 mol·L-1的一组溶液pH由大到小排列为:
NaOH>Na2CO3>NaHSO4>(NH4)2SO4
D.分别稀释10mLpH=1的盐酸和醋酸至100mL,后者pH变化大,说明醋酸是弱酸
14.下列化学过程及其表述正确的是 ( )
A.向NaSO,溶液中滴人Ba(OH)2溶液呈中性
H++SO2-4+Ba2++OH-===BaSO4↓+H2O
B.由水电离的c(H+)=10-13mol·L-1的溶液中,Na+、NO-3、SO2-4、Cl-能大量共存
C.向含有1mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总物质的量为3 mol
D.我国首创的海洋铝电池,采用铂网作为正极,该电池负极的电极反应式为:
O2+2H2O+4e-→4OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com