
题目列表(包括答案和解析)
28.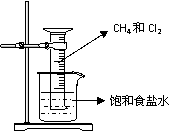 (16分)某课外兴趣小组利用如右图装置探究甲烷与氯气的反应,根据题意回答下列问题:
(16分)某课外兴趣小组利用如右图装置探究甲烷与氯气的反应,根据题意回答下列问题:
(1)反应前,量筒内CH4与Cl2的体积比为 。
向100mL量筒中充入CH4和Cl2的方法是 。
(2)CH4与Cl2发生反应的条件是 。
若用日光直射,可能会引起 。
(3)实验中可观察到的实验现象有:量筒内壁上出现油状液滴,饱和食盐水中有少量固体析出, , 等。
(4)实验中生成油状液滴都是有机物,其中 是工业上重要溶剂(写化学式)。
(5)此实验用饱和食盐水而不用水的原因是 。
27.(14分)a、b、c、d、e分别为MgCl2、KHSO4、KOH、NaHCO3、AlCl3五种溶液中的一种,其中a能与其余四种溶液反应,b与d反应只产生气泡;e只能与a反应且有明显现象。
(1)根据以上实验事实可知:a是 ;c是 ;e是 。
(2)暂不能确定的物质是 (填写代号),若要进一步鉴别,应选 溶液(在此五种溶液范围内选),发生明显现象的反应的离子方程式为 。
(3)若以上五种溶液的物质的量浓度相同,则溶液的pH由大到小的顺序为 。
26.(16分)A、B、C、D、E是含有同一元素的常见物质。C物质只由一种元素组成,在1个C分子中形成共价键的电子数与分子中所含电子数之比为3∶7。C、E均可与氧气在一定条件下反应生成A。请回答以下问题:
(1)常温下将气体B通入水中发生反应,生成A和D,则D的化学式为 。
(2)E的空间构型是 ;
写出E与氧气反应生成A化学方程式 。
(3)D与E反应的生成物在固体时的晶体类型是 ;
其水溶液中离子浓度由大到小的顺序是 。
(4)写出工业上合成E反应的化学方程式 ;
若使平衡向生成E的方向移动,可采取的措施有 (填写字母)。
A.升高温度 B.增大压强 C.使用催化剂 D.液化分离E
(5)在标准状况下,2.24LE气体在氧气中完全燃烧生成气体单质C和液态水,放出热量QkJ,则该反应的热化学方程式为 。
13.下列说法中,正确的是 ( )
A.电解精炼铜时,同一时间内阴极析出铜的质量比阳极溶解铜的质量大
B.电解饱和食盐水制烧碱采用离子交换膜,可防止阴极室产生的Cl2进入阳极室
C.在原电池反应中,负极发生还原反应
D.在电解过程中,阴极发生氧化反应
12.等温度下,体积一定的密闭容器中进行如下的可逆反应:
X(g) + Y(g) Z(g) + W(s);∆H>0 下列叙述正确的是
( )
Z(g) + W(s);∆H>0 下列叙述正确的是
( )
A.加入少量W,逆反应速率增大
B.当容器内气体压强不变时,反应达到平衡
C.升高温度,平衡向逆方向移动
D.平衡后加入X,上述反应的∆H增大
11.下列各组离子在给定条件下能大量共存的是 ( )
A.在pH=1的溶液中:K+、NH4+、ClO―、Cl―
B.有SO42―存在的溶液中:Na+、Mg2+、Ca2+、I―
C.有NO3―存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br―
D.在c(H+)=1.0×10―13mol/L的溶液中:Na+、S2―、AlO2―、SO32―
10.对于醋酸溶液的下列说法中,不正确的是 ( )
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH―)+c(CH3COO―)
B.醋酸溶液中加入少量醋酸钠晶体,醋酸电离程度减小
C.0.1mol/L的醋酸溶液中加水稀释,溶液中c(OH―)减小
D.常温下,pH=3的醋酸溶液与pH=11的烧碱溶液等体积混合后,溶液中c(H+)<c(OH―)
9.下列叙述正确的是 ( )
A.甲烷、乙烯和苯在工业上都可通过石油分馏得到
B.1个甘氨酸分子中存在10对共用电子
C.为了除去苯中少量的苯酚,向混合物中加入适量的溴水后过滤
D.含有6个碳原子的有机物,每个分子中最多可形成5个C-C键
8. 根据下表的信息,判断以下叙述正确的是 ( )
表:部分短周期元素的原子半径及主要化合价
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.061 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.氢化物的还有性:H2R<H2T
B.单质与稀盐酸反应的速率:L<Q
C.在水溶液中得不到M与R的化合物
D.L2+与R2―的核外电子数相等
7.下列各组固体物质中,在加水或加热的条件下,都能放出CO2的是 ( )
A.NaHCO3和Al2(SO4)3 B.NaHCO3和Na2CO3
C.MgSO4和CaCO3 D.Na2CO3和Al(NO3)3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com