
题目列表(包括答案和解析)
18.(12分)吲哚昔酚 (idoxifene)可用于治疗骨质疏松症,它的合成路线如下:
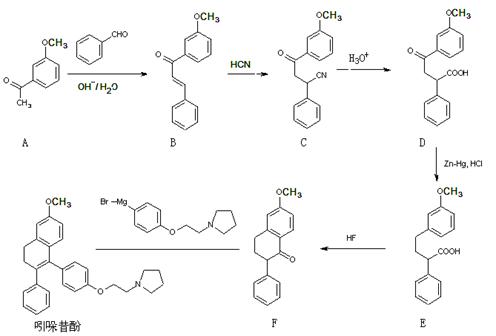
图表 1高 考 资 源 网
(1)反应类型:B→C ▲ ;D→E ▲ 。
(2)D中含氧官能团有: ▲ (写名称)。
(3)满足下列三个条件的A的同分异构体数目有 ▲ 种。
①苯的衍生物,且苯环上只有两个互为对位的取代基;②能发生银镜反应;
③与FeCl3溶液作用不显色
(4)E→F中还有一种副产物G生成,G与F互为同分异构体,且含有三个六员环,G结构简式为: ▲ 。w ww.k s5u. co m
(5)2,2-二甲基戊酸[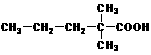 ]是有机合成中间体,请设计合理的方案以丙酮(
]是有机合成中间体,请设计合理的方案以丙酮( )为唯一有机原料合成2,2-二甲基戊酸(用合成路线流程图表示,并注明反应条件)。
)为唯一有机原料合成2,2-二甲基戊酸(用合成路线流程图表示,并注明反应条件)。
提示:①合成过程中无机试剂任选;②丙酮分子间能发生上图合成路线中A→B的类似反应;③合成路线流程图示例如下:
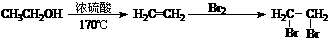
▲
17.(8分)纳米TiO2作为一种光催化剂越来越受到人们的关注,现正广泛开发运用。
(1)制取纳米TiO2的方法很多,氢氧火焰水解法是将TiCl4气体导入氢氧火焰中(700-1000℃)进行水解,其化学反应式为: ▲ 。
 (2)纳米二氧化钛可光解挥发性有机污染物(VOCs),若无水蒸气存在,三氯乙烯降解反应为:C2HCl3+2O2→2CO2+HCl+Cl2,若有足够量的降解后的尾气,实验室检验产物中有氯气的简单方法是: ▲ ;通过质谱仪发现还有多种副反物,其中之一为:
(2)纳米二氧化钛可光解挥发性有机污染物(VOCs),若无水蒸气存在,三氯乙烯降解反应为:C2HCl3+2O2→2CO2+HCl+Cl2,若有足够量的降解后的尾气,实验室检验产物中有氯气的简单方法是: ▲ ;通过质谱仪发现还有多种副反物,其中之一为: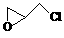 ,则该有机物核磁共振氢谱有 ▲ 个峰。
,则该有机物核磁共振氢谱有 ▲ 个峰。
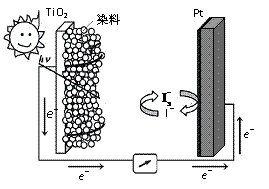
(3)利用半导材料TiO2与染料、铂电极及I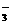 和I-的混合物作电解质(I2+I-
和I-的混合物作电解质(I2+I- I
I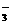 ),可构成染料敏化太阳能电池(DSSCs)工作原理如右图,该电池工作时,正极的电极反应为: ▲ 。
),可构成染料敏化太阳能电池(DSSCs)工作原理如右图,该电池工作时,正极的电极反应为: ▲ 。
(4)在不同的载体(钛片、铝片、陶瓷)表面制备二氧化钛薄膜,来考察不同载体TiO2薄膜光催化使甲基橙脱色,每次光照20min取一次样,实验结果如下。w ww.k s5u. co m

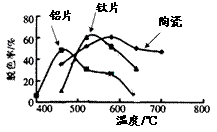 下列说法正确的是 ▲ 。
下列说法正确的是 ▲ 。
(a)不同载体,无论何种温度一定是钛片最好
(b)约在520℃时,钛片载体的光催化活性最好
(c)无论何种载体,催化活性总是随温度的升高而升高
(d)不同负载TiO2薄膜的光催化活性不同
16.(10分)钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉冶炼,常用赤铁矿、焦炭、空气和熔剂(石灰石)作原料。已知赤铁矿被还原剂还原时是逐级进行的,还原时温度及CO、CO2平衡混合气体中CO的体积分数的关系如下图:
 (1)铁在元素周期表中位于 ▲ 周期 ▲
族
(1)铁在元素周期表中位于 ▲ 周期 ▲
族
(2)在温度低于570℃时,还原分两阶段完成,在温度高于570℃时,依次发生的还原反应有:
▲ (选用右图中的a、b、c、d填空)
(3)为减少高炉冶铁时,含CO的尾气排放,下列研究方向不可取的是 ▲ 。
(a)其它条件不变,增加高炉的高度
(b)调节还原时的炉温
(c)增加原料中焦炭与赤铁矿的比例
(d)将生成的铁水及时移出
(4)已知下列反应数值:
|
反应序号 |
化学反应 |
反应热 |
|
① |
Fe2O3(s)+3CO(g)=2Fe(s)+3CO 2(g) |
△H1= -26.7kJ·mol-1 |
|
② |
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) |
△H2= -50.8kJ·mol-1 |
|
③ |
Fe3O4(s)+CO(g)=3FeO(s)+CO2 (g) |
△H3= -36.5kJ·mol-1 |
|
④ |
FeO(s)+CO(g)=Fe(s)+CO2(g)
|
△H4 |
反应④△H4= ▲ kJ·mol-1。
(5)1100℃时, FeO(s)+CO(g)
 Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为: ▲ 。w ww.k
s5u. co m
Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为: ▲ 。w ww.k
s5u. co m
15.(8分)汞不溶于水,易挥发,易与许多金属形成合金,汞是对人体危害较大的一种金属,据统计世界上有80多种工业以汞为原料,生产过程中产生的汞的污染越来越引起人们的重视,水体中的无机汞主要有Hg2+、Hg22+。
(1)实验时倘若不慎,将汞溅落地面时,可先用涂上X溶液的锌片去粘拾,然后再用足量的X溶液溶解锌片回收汞,X溶液可以是 ▲ (填试剂名称)。
(2)检测水体中的Hg2+可用KI及CuSO4溶液与其反应生成橙红色Cu2HgI4沉淀,用漫反射光谱直接测定汞沉淀物,该反应的离子方程式可表示为: ▲ 。
(3)冶金厂治理含汞、含硫的烟气并回收汞,中国冶金工作者在研究Hg-I-H2O系热力学的基础上,查明KI溶液能有效吸收汞,吸收总反应为:2Hg+SO2+8I一+4H+ =2HgI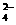 +S+2H2O,最后进行电解吸收液(K2HgI4),阴极的电极反应式为: ▲ 。
+S+2H2O,最后进行电解吸收液(K2HgI4),阴极的电极反应式为: ▲ 。
(4)国家制定的工业废水排放标准:汞的含量≤0.05 mg/L。某合作学习小组的同学拟用硫化钠法处理含汞废水,其步骤为:先将溶液pH调至8-10,然后加入稍过量的硫化钠溶液,最后加入一定量的FeSO4溶液,过滤后排放。已知:25℃HgS的Ksp= 4×10-52;Hg2S的Ksp=1.0×10-47,FeS 的Ksp=6.3×10-18;HgS+Na2S Na2HgS2(易溶)。
Na2HgS2(易溶)。
①若操作程序完全正确,且废水中只含无机汞,上述处理后的废水能否达标排放 ▲(选填:“能”或“不能”)
②加入FeSO4溶液的作用是 ▲ 。w ww.k s5u. co m
14.(8分)以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高。其主要流程如下:
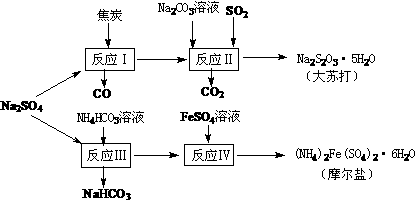
试回答下列问题:w ww.k s5u. co m
(1)已知反应Ⅰ中发生的主要反应为:Na2SO4(s)+4C(s)= Na2S(s)+4CO(g)△H=+569.99 kJ/mol,欲使该反应发生并维持该反应进行的条件是 ▲ 。
(a)常温 (b)常温,并通入少量CO2 (c)高温,并通入适量的O2
(2)配平反应Ⅱ的化学方程式: □Na2S+□Na2CO3+□SO2 =□Na2S2O3+□CO2 ▲
(3)反应Ⅲ温度需控制在35-40℃的较低温度,其主要原因是 ▲ 。
(4)在摩尔盐溶液中加入一种物质的溶液可使NH4+、Fe2+、SO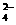 都大量减少,该物质是
都大量减少,该物质是
▲ 。
(5)反应Ⅳ中两种盐溶液混合时,需加入适量的H2SO4,将溶液pH调到1,用离子方程式说明原因: ▲ 。
13.(10分)三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:

(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因 ▲ ,如何用简单方法判断其已洗涤干净 ▲ 。w ww.k s5u. co m
(2)已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,适宜的加热方式是 ▲ 。

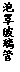
 (3)用右图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通人氮气,使CCl4蒸气经氮气载人反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度控制在50-60℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通人氮气;⑥检查装置气密性。正确的顺序为:⑥→③→ ▲ 。
(3)用右图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通人氮气,使CCl4蒸气经氮气载人反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度控制在50-60℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通人氮气;⑥检查装置气密性。正确的顺序为:⑥→③→ ▲ 。
(4)已知反应管中发生的主要反应有:Cr2O3 + 3CCl4 → 2CrCl3 + 3COCl2,因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为 ▲ 。
(5)样品中三氯化铬质量分数的测定
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O 存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
已知:Cr2O +6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
①该实验可选用的指示剂名称为 ▲ 。w ww.k s5u. co m
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是 ▲ 。
③样品中无水三氯化铬的质量分数为 ▲ 。
12.水的电离平衡曲线如右图所示,下列说法不正确的是
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显酸性
第Ⅱ卷(非选择题 共78分)
11.直接NaBH4/H2O2燃料电池(DBFC)的结构如右图,有关该电池的说法正确的是
A.电极B材料中包含MnO2层,MnO2可起催化作用
B.电池负极区的电极反应为:w ww.k s5u. co m
BH +8OH――8e-=BO
+8OH――8e-=BO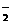 +6H2O
+6H2O
 C.放电过程中,Na+ 从正极区向负极区迁移
C.放电过程中,Na+ 从正极区向负极区迁移
D.在电池反应中,每消耗1L 6 mol/LH2O2溶液,理论
上流过电路中的电子为6NA个
10.下列溶液中微粒的物质的量浓度关系正确的是
A.25℃时,pH=7的NH4Cl与NH3·H2O混合溶液:c(H+)= c(OH-)=c(NH )=c(Cl-)
)=c(Cl-)
B.0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+2c(H2S)
C.25℃时,pH=2的HCOOH与pH=12的NaOH等体积
混合:c(HCOO-)+ c(H+)<c(Na+)+c(OH-)
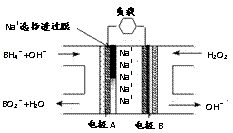 D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积
D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积
混合:3c(CO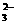 )+3c(HCO
)+3c(HCO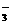 )+3c(H2CO3)=2c(Na+)
)+3c(H2CO3)=2c(Na+)
9.下列离子方程式与所述事实相符且正确的是
A.用H2O2酸性溶液,将海带灰中的I-转变为I2,H2O2+2I-=I2+2OH-
B.溴乙烷与氢氧化钠水溶液共热:C2H5Br + OH- 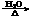 CH2=CH2↑+Br-+H2O
CH2=CH2↑+Br-+H2O
C.高锰酸钾与足量浓盐酸反应制氯气:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O
D.漂白粉溶液中,通入过量的二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com