
题目列表(包括答案和解析)
8. 霉酚酸(Mycophenolic acid)是一种生物活性化合物。下列有关霉酚酸的说法正确的是w ww.k s5u. co m
霉酚酸(Mycophenolic acid)是一种生物活性化合物。下列有关霉酚酸的说法正确的是w ww.k s5u. co m
 A.分子式为:C17H20O6
A.分子式为:C17H20O6
B.处于同一平面的碳原子至多9个
C.不能与FeCl3溶液发生显色反应
D.一定条件下, 1 mol霉酚酸最多可与2 mol NaOH反应
7.下列化学实验事实及其解释都正确的是w ww.k s5u. co m
A.滴有酚酞的碳酸氢钠溶液呈浅红色,微热后红色加深,是因为碳酸氢钠分解生成了碳酸钠
B.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
C.用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2反应是放热反应
D.向溴水中滴入植物油,振荡后,油层显无色,说明溴不溶于油脂
6.X、Y、Z、R、W是5种短周期元素,原子序数依次增大,它们可组成离子化合物Z2Y和共价化合物RY3、XW4,已知Y、R同主族, Z、R 、W同周期。下列说法不正确的是
A.原子半径:Z>R>W
B.X2W6分子中各原子均满足8电子结构
C.气态氢化物稳定性:HmW>HnR
D.Y、Z、R三种元素组成的化合物水溶液一定显碱性w ww.k s5u. co m
5.在下列各组溶液中,离子间一定能大量共存的是
A.pH=1的溶液:K+、Cu2+、Br-、SO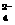 w ww.k s5u. co m
w ww.k s5u. co m
B.含有0.1mol/LI-的溶液:NH 、Fe3+、SO
、Fe3+、SO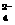 、Cl-
、Cl-
C.含有0.1mol/LHCO3-的溶液:Na+、Al3+、NO 、OH-
、OH-
D.强酸性溶液:K+、Mg2+、NO 、ClO-
、ClO-
4.化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.K2FeO4能与水缓慢反应生成Fe(OH)3和O2,故可用作水的消毒剂和净化剂
B.钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用
C.常温下氨能与氯气反应生成氯化氢和氮气,因此可用浓氨水检查氯气管道某处泄漏
D.用氯气与乙烷混合光照获得纯净的1,2-二氯乙烷
3.用NA表示阿伏加德罗常数的值。下列叙述正确的是w ww.k s5u. co m
A.25℃时,pH=3的1.0LNaHSO3溶液中,含Na+数目为0.001 NA
B.2.3g甲苯和丙三醇的混合物中,含氢原子数目为0.2NA
C.标准状况下,2.24L溴乙烷中含共价键数目为0.7 NA
D.5.6gFe投入100mL 3.5mol/L硝酸中,充分反应,转移电子总数为0.3 NA
2.下列化学用语表示正确的是 w ww.k s5u. co m
A.NaH与重水反应的方程式:NaH+D2O=NaOH +D2↑
 B.三氟化氮的电子式:
B.三氟化氮的电子式: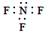
C.熔融状态下硫酸氢钠的电离方程式:NaHSO4(熔融)=Na++HSO4-
D.羟基乙酸(HOCH2COOH)的缩聚物: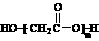
1.每年3月22日是世界水日,联合国确定的2010年“世界水日”主题是“关注水质、抓住机遇、应对挑战”。下列有关说法或做法不符合这一主题的是
A.科学使用农药、化肥,减少水体污染
B.工业废水和城市生活污水需净化处理,坚持达标排放
C.为了节约生产成本,可将造纸厂、化工厂建在水源地上游
D.合理开发水资源,建立水资源节约型和环境友好型经济
20.(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.由徐光宪院士发起, 院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、 H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星。
(1)下列说法正确的是 ▲ 。
 (a)BF3和NH3都是含有极性键的非极性分子
(a)BF3和NH3都是含有极性键的非极性分子
(b)CO2、HCN分子中都含有两个 键和两个π键
键和两个π键
(c)H2S、O3分子都是直线形w ww.k s5u. co m
(d)一种双环单萜龙脑(如右图)分子中有4个手性碳原子
(2)NO是人体中的信号分子,有关说法正确的 ▲ 。
 (a)第一电离能N大于O (b)电负性O大于N
(a)第一电离能N大于O (b)电负性O大于N
(c)NO+的结构为:N≡O+
(d)N、O元素在周期表中都处于p区
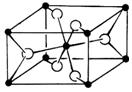
(3)TiO2的天然晶体中,最稳定的一种晶体结构如右图,白球表示: ▲ 原子。
 (4)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基形成的一类配合物,其中Fe2+在基态时核外电子排布式为: ▲ ;实验室测定铁的含量可用配位剂邻二氮菲(
(4)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基形成的一类配合物,其中Fe2+在基态时核外电子排布式为: ▲ ;实验室测定铁的含量可用配位剂邻二氮菲( ),它能与Fe2+形成红色配合物(如右图),该配离子中Fe2+配位数为 。
),它能与Fe2+形成红色配合物(如右图),该配离子中Fe2+配位数为 。
(5)乙酸熔沸点很高,是由于存在以分子间氢键缔合的二聚体(含一个环状结构),请画出这二聚体的结构: ▲ 。
B.聚合氯化铝(PAC)可以看成是AlCl3水解成为Al(OH)3的中间产物,其化学通式为[Al2(OH)nCl6-n]m(m≤10,n=3-5)。若式中,n接近于6或等于6,则可称为铝溶胶。聚合氯化铝是一种无机高分子混凝剂。某合作学习小组的同学在查阅文献资料后拟用不同的方法制备聚合氯化铝。w ww.k s5u. co m
(1)甲组用凝胶-溶胶法,它们用结晶氢氧化铝、烧碱、CO2及盐酸为试剂生产,其中涉及的氢氧化铝与烧碱反应的化学方程式为: ▲ 。
(2)乙组采用不足量酸溶法,原料主要是铝加工的下脚料铝屑、铝灰和铝渣等,反应原理为:2Al +(6-n)HCl+nH2O = Al2(OH)nCl6-n+3H2↑。该制备方法工艺简单、成本低,利用本身是放热反应,故不需要加热,可能缺点有: ▲ (列举一条)。
(3)丙组拟用高岭土(Al2O3•2SiO2•2H2O)等为原料,经焙烧、盐酸浸取、聚合、熟化、蒸发、干燥等步骤得到固体PAC。其中液体PAC蒸发时,适宜在110℃左右,你认为适宜的加热方法是 ▲ 。
(4)丁组同学对甲、乙、丙组同学制得的样品进行定性实验,请你补充下列实验报告
|
实验序号 |
实验步骤 |
实验现象 |
结论 |
|
① |
用激光笔照射甲组制得的PAC溶液 |
光亮的通路 |
▲ |
|
② |
取乙组制得的样品少许加入铝试剂阿罗明拿 |
变成玫瑰红色 |
▲ |
|
③ |
取丙组样品少许,溶于适量的水制得的淡黄色透明液体中加入氟化铵 |
▲ |
▲ |
(5)戊组同学对丙组固体样品请质检部门用27Al-NMR测试,其中的分散质主要是:Al13O4(OH)24Cl7,属于优质产品。他们另取样品mg少许放在坩埚中充分加热并灼烧,最终得到的固体产物为: ▲ ,若得到固体ng,则制得的样品中铝的质量分数为 ▲ 。


图表 2

19.(10分)合成氨联产二甲醚是一项具有中国特色的化工工艺,具有节能环保,其主要工艺流程如下:


 已知造气时,主要发生的反应有:CH4+H2O→CO+3H2………①;2CH4+O2→2CO+4H2………②。
已知造气时,主要发生的反应有:CH4+H2O→CO+3H2………①;2CH4+O2→2CO+4H2………②。
CO、CO2均可与H2合成甲醇,合成甲醇后排出的醇后气中有很少量的CO、CO2,需与H2转化为甲烷,防止CO使合成氨催化剂中毒。
(1)NH3(g)→NH3(l) △H ▲ 0 (填:“>”、“<”或“=”,下同) ; △S ▲ 0。
(2)相同体积的天然气,采用“合成氨同时联产二甲醚”和直接合成氨相比,新工艺优越性有 。w ww.k s5u. co m
(a)减少二氧化硫排放 (b)适应低碳经济
(c)可提高氮肥产量 (d)资源综合利用率和经济效益高
(3)在催化剂、高温、高压下,CO2转化为甲烷的化学方程式为 ▲ 。
(4)假定造气时产生的转化气中不含CO2, H2与CO物质的量之比为2.2,空气由80%N2和20%O2组成,天然气中CH4为100%,且①和②的转化率均为100%。则同温同压下通入的空气和水蒸气的体积比,V(空气)/V(水蒸气)= ▲ 。
(5)今有224m3(已折合成标准状况)由CO、H2、N2组成的混合气体,分别合成甲醇和氨,且三种气体均完全转化,驰放气中甲烷忽略不计,若得到液氨34kg,则同时得到二甲醚多少千克? ▲ w ww.k s5u. co m
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com