
题目列表(包括答案和解析)
29.(16分)已知溴水中存在化学平衡:Br2+H2O HBr+HBrO,乙烯通入溴水中,生成A、B(B的分子式为C2H5BrO)和C2H5Br。
HBr+HBrO,乙烯通入溴水中,生成A、B(B的分子式为C2H5BrO)和C2H5Br。
 回答下列问题:
回答下列问题:
(1)E的分子式为______________。G中含氧官能团的名称是______________。
(2)B的结构简式为_____________________,I的结构简式为_______________________
(3)A-I中,能发生银镜反应的物质的结构简式是_________________________________
(4)写出由G转化为H的化学方程式:__________________________________________
(5)指出以下转化的反应类型为的:乙烯→A_______、 G→H_________________。
28.(16分)下图甲是旧教材中验证铜与浓硝酸反应的装置,乙是新教材对演示实验改进后的装置,丙是某校师生对乙作进一步改进并对所产生的气体的性质进行探究的装置。
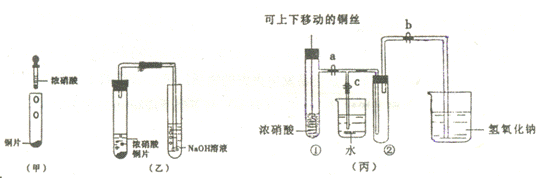
(1)写出铜和浓硝酸反应的化学方程式 。
(2)与甲装置相比,乙装置的优点是 ,
丙装置除具乙装置优点外还具有的优点是 。
(3)欲使NO2气体充满试管②,应先关闭弹簧夹 ,再打开弹簧夹 ,当气体充满②后,将铜丝提起与溶液脱离,然后把a、b、c都关闭,并把试管②置于沸水中,下列情况不变的是 。
A.颜色 B.平均摩尔质量 C.质量
D.压强 E.密度
(4)为了验证NO2与水的反应,欲使烧杯中的水进入试管②的操作是
。
(5)试管②中的NO2和水充分反应后,所得溶液物质的量浓度最大值是 。
(气体体积按标准状况计算且不考虑实验过程中NO2的损失)
27.(10分)已知一氧化碳与水蒸气的反应为:CO(g)+H2O (g) CO2(g)+H2(g) ,800℃时,在容积为2.0L的密闭容器中充入2.0mol CO(g)和3.0mol H2O(g),保持温度不变,4 min后反应达到平衡,测得CO的转化率为60%。
CO2(g)+H2(g) ,800℃时,在容积为2.0L的密闭容器中充入2.0mol CO(g)和3.0mol H2O(g),保持温度不变,4 min后反应达到平衡,测得CO的转化率为60%。
(1)平衡时H2O的物质的量为 mol。
(2)800℃时该反应的平衡常数K= 。
(3)427℃时该反应的化学平衡常数为9.4,请结合(2)中的计算结果判断该反应的
ΔH 0(填“>”“<”或“=” ),升高温度,平衡常数将
(填“增大”、“减小”、“不变”)。
 (4)请在坐标图中,画出上述反应过程H2O的物质的量随时间变化的图像(用实线)。假定反应温度高于800℃(其它条件均不变),在坐标图中再次画出H2O的物质的量随时间变化的示意图(用虚线)。
(4)请在坐标图中,画出上述反应过程H2O的物质的量随时间变化的图像(用实线)。假定反应温度高于800℃(其它条件均不变),在坐标图中再次画出H2O的物质的量随时间变化的示意图(用虚线)。
26.(16分)四种短周期元素A、B、C、D的性质或结构信息如下。
信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:

甲:是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生
物体最重要的组成部分。
乙:无色,无味而易燃,是常见的能源物质。
丙:有强氧化性,可以用于消毒杀菌。
请根据上述信息回答下列问题。
(1)甲、乙、丙中含有共同元素是 (填名称)。丙溶于甲中可生成一种10
电子微粒,用化学用语表示这一过程_____________________________。
(2)B元素在周期表中的位置 ,写出A原子的电子式 。
(3)举例说明B元素形成的单质晶体类型可能有 、 。(举两例,注:每条短线上填物质、晶体类型)
(4)A、B、C可分别与D形成的化合物a、b、c。这些化合物分子的沸点高低顺序可能为(用具体化学式表示) 。
(5)A的单质可跟与之同周期元素形成某种氧化物的水溶液发生氧化还原反应,写出相关反应的离子方程式______ ___________________。
13.某同学用镀铜的石墨做阳极、石墨做阴极电解稀硫酸溶液,用曲线Ⅰ表示电解过程中阴极增加的质量(△m)随时间(t)的变化关系,用曲线Ⅱ表示溶液pH随时间(t)的变化关系。下列曲线图合理的是(电解初期溶液中H+放电) ( )

12.下列有关描述中不正确的是 ( )
A.在所有氧化还原反应中,氧化剂的氧化性一定强于氧化产物的氧化性
B.反应A(g)+3B(g)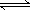 2C(g)达平衡后,温度不变,增大压强,平衡正向移动但平衡常数K不变
2C(g)达平衡后,温度不变,增大压强,平衡正向移动但平衡常数K不变
C.在KI溶液中加入氯化银固体,一段时间后沉淀变成黄色,说明同温度下KSP(AgI)< KSP(AgCl)
D.常温下硝酸铵溶于水是一个能自发进行的吸热过程,说明该过程的△S>0
11.用NA表示阿伏加德罗常数的值。下列叙述正确的是 ( )
A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
B.标准状况下,22.4L己烷中共价键数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-
10.某酸性溶液中只含NH4+、C1-、H+、OH-四种离子,下列说法不正确的是 ( )学科 A.可由pH=3的HC1与pH=11的NH3·H2O溶液等体积混合而成
B.该溶液中离子间一定满足:c(NH4+)+c(H+)=c(OH-)+c(C1-)
C.加入适量NH3·H2O,溶液中离子浓度可能为:c(NH4+)>c(C1-)>c(OH-)>c(H+)
D.该溶液可由等物质的量浓度、等体积的HC1溶液和NH3·H2O溶液混台而成
9.下列反应的离子方程式书写正确的是 ( )
A.硫酸铜溶液中加过量的氨水:Cu2++2NH3·H2O==Cu(OH)2↓+2NH4+
B.用食醋检验牙膏中碳酸钙的存在:CaCO3+2H+==Ca2++CO2↑+H2O
C.苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O-→C6H5OH+HCO3-
D.用碘化钾淀粉溶液检验亚硝酸钠中NO2-的存在:NO2-+2I-+2H+==NO↑+I2+H2O
8.短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列推断正确的是( ) A.还原性:cY2->dZ- B.碱性:XOH<W(OH)2
C.原子半径:W>X>Z>Y D.热稳定性:H2Y<HZ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com