
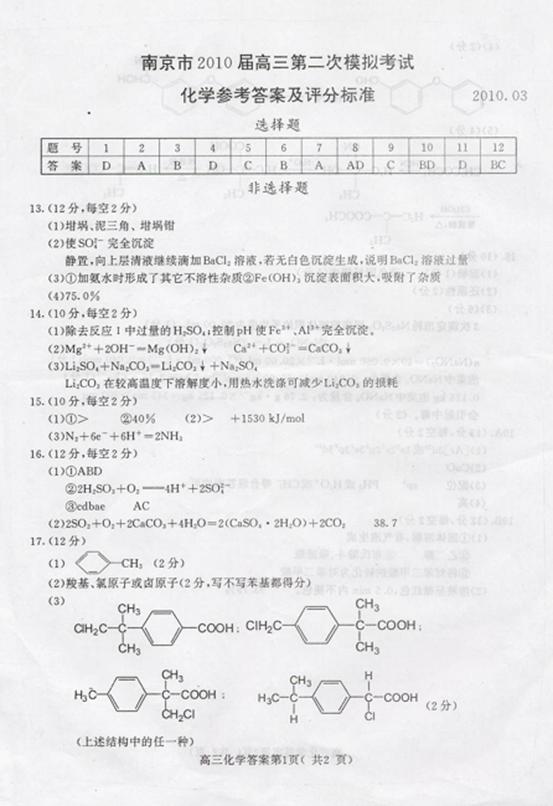
题目列表(包括答案和解析)
1.温家宝总理在2010年政府工作报告中提出:“要大力开发低碳技术,推广高效节能技术,积极发展新能源和可再生能源。”下列有关做法与此不相符的是
A.大力开发丰富的煤炭资源,减少对石油的依赖
B.回收废弃饮料包装纸,制作成公园内的休闲长椅
C.在西部和沿海地区兴建风力发电站,解决能源问题
D.鼓励购买小排量汽车,推广与发展电动、混合动力汽车
19.(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内做答。若两题都做,将按A题评分。
A.纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+1价的化合物。
 (1)写出基态
(1)写出基态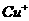 的核外电子排布式
;
的核外电子排布式
;
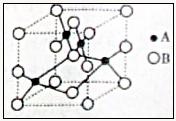
(2)右图是铜的某种氧化物的晶胞示意图,该氧化物
的化学式为 ;
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水到
沉淀刚好全部溶解可得到森蓝色溶液,继续向其中加入极
性较小的乙醇可以生成深蓝色的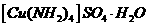 沉淀,该物质中的
沉淀,该物质中的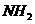 通过
键与中心离子
通过
键与中心离子 结合,
结合,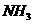 分子中N 原子的杂化方式是
。与
分子中N 原子的杂化方式是
。与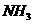 分子互为等电子体的一种微粒是
。
分子互为等电子体的一种微粒是
。
(4)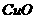 的熔点比
的熔点比 的熔点
。(填“高”或“低”)
的熔点
。(填“高”或“低”)
B.目前市场上大量碳酸饮料、矿泉水、食用油等产品包装瓶几乎都是用PET(聚对苯二甲酸乙二醇脂,简称聚酯)制作的。某科学小组利用费聚酯饮料瓶制备对苯二甲酸。部分有机物的性质如下:
|
名称 |
性质 |
|
乙二醇 |
无色粘稠吸湿液体,易燃,沸点:196-198℃,与水混溶。 |
|
丙酮 |
无色易燃液体,沸点:56.5℃,溶于水及大多数有机溶剂。 |
|
N,N二甲基甲酰胺(DMF) |
易燃,低毒,沸点:153℃,能与水和大多数有机溶剂混溶。 |
|
对苯二甲酸(TPA) |
白色针状结晶或粉末,可燃,熔点:425℃(分解),约在300℃升华,不溶于水,微溶于热乙醇,溶于碱溶液。电离常数: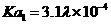 , ,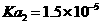 |
实验过程如下,试回答下列问题:
(1)对苯二甲酸的制备
① 在100mL四颈瓶上分别装置冷凝管、搅拌器和温度计。然后依次加入5.00g废饮料瓶碎片、0.05g氧化锌、5g碳酸氢钠和25mL乙二醇。缓慢搅拌,油浴加热,将温度升至180℃(不超过185℃),在此温度下反应15分钟。
反应过程中的现象是 。
② 冷却至160℃左右停止搅拌,将搅拌回流装置改成搅拌、减压蒸馏装置,减压蒸馏。这一步是为了分离出 。
③ 向四颈瓶中加入50mL沸水,搅拌使四颈瓶中的残留物溶解。抽滤除去少量不溶物。抽滤需要用到的主要仪器有 。
④ 将滤液转移到400mL烧杯中,用25mL水荡洗滤瓶并倒入烧杯中,再添加水使溶液总体积达200mL丙酮分2次洗涤,抽干,干燥。
(2) 对苯二甲酸含量的测定
称取0.2000g对苯二甲酸样品于250mL烧杯中,加入30mL DMF,搅拌溶解,加入10 mL蒸馏水,搅匀后加4滴酚酞指示剂,用0.1000 mol·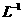 氢氧化钠标准溶液滴定,消耗氢氧化钠标准溶液体积为22.60mL。
氢氧化钠标准溶液滴定,消耗氢氧化钠标准溶液体积为22.60mL。
滴定终点的现象是 。
所测样品中对苯二甲酸的质量分数为 。


18.(10分)一般情况下,当人体一次性摄取300mg-500mg亚硝酸钠时,就会引起中毒。某研究小组用碘量法测定泡菜中亚硝酸盐的含量。有关反应如下:
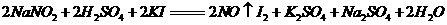

取1kg泡菜,榨汁,将榨出的液体收集后,加入提取剂和氢氧化钠,使得到的泡菜汁中的亚硝酸盐都成为要硝酸钠。在过滤后的滤液中加入氢氧化铝乳液,以除去色素。再次过滤后得到滤液,将该滤液稀释至1L,取25.00mL稀释后的滤液与过量的稀硫酸和碘化钾溶液反应,在选用合适的指示剂,用0.05000mol·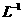
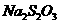 标准溶液进行滴定。实验数据记录如下;
标准溶液进行滴定。实验数据记录如下;
|
滴定次数 |
0.05000mol·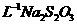 标准溶液体积/mL 标准溶液体积/mL |
|
|
滴定前刻度 |
滴定后刻度 |
|
|
1 |
0.00 |
20.04 |
|
2 |
0.12 |
20.08 |
|
3 |
0.05 |
20.05 |
请回答下列问题:
(1)该实验中可选用的指示剂是 ,滴定终点的现象是 。
(2)有经验的厨师在做泡菜时往往加入适量的橙汁,以减轻亚硝酸盐的危害。这主要是因为橙汁中含有丰富的维生素C,维生素C具有 性(填“氧化性”或“还原性”)
(3)通过计算判断若某人遗一次食入0.125kg这种泡菜,是否会引起中毒?
17.(12分)高效、低毒农药杀灭菊酯的合成路线如下:
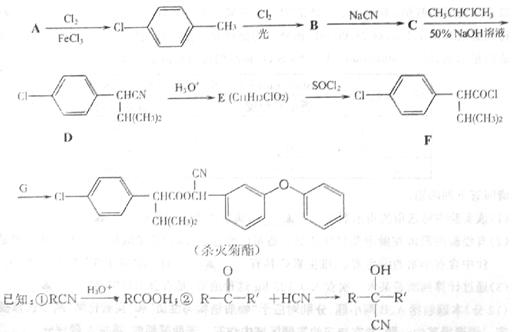
(1)写出A的结构简式
(2)写出E中官能团的名称 。
(3)写出符合下列条件的E的一种同分异构体的结构简式 。
①苯的衍生物,且苯环上只有两个对位取代基;
②与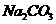 溶液反应放出
溶液反应放出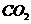 气体
气体
③氯原子不与苯环上碳原子相连,且与 醇溶液共热不能发生消去反应;
醇溶液共热不能发生消去反应;
④分子中含有两个甲基。
(4)G可由一种含有醛基的物质和 加成制得,写出合成G的化学方程式 。
加成制得,写出合成G的化学方程式 。
(5)请设计合理的方案以丙酮(CH3COCH3)和甲醇为原料合成有机玻璃的单体甲基丙烯酸甲酯
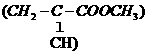
(用合成路线流程图表示,并注明反应条件)。
提示:①合成过程中无机试剂任选;②合成路线流程图示例如下:
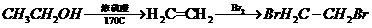
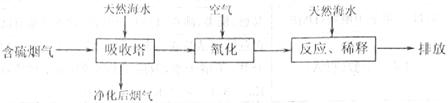
16.(12分)烟气脱硫电控制二氧化硫污染的主要技术手段。
(1)利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟
气的模拟实验,实验结果如下图所示。
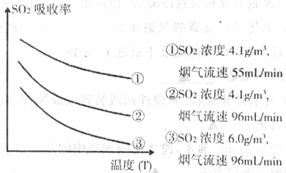
①根据图示实验结果,为了提高一定浓度含硫烟气中SO2的吸收效率,下列措施正确的是 。
A.降低通入含硫烟气的温度 B.减小通入含硫烟气的流速
C.减少天然海水的进入量 D.在天然海水中加入生石灰
②天然海水吸收了含硫烟气后会溶有H2SO3,使用空气中的氧气将其氧化,写出该反应的离子方程式 。
③该小组采用下图装置在实验室测定烟气中SO2的体积分数(假设实验在标准状况下进 行):

上述装置组装连接的顺序是:原料气→ (填a、b、c、d、e)。下列试剂中(浓
度、体积一定),可以用来代替试管中的碘-淀粉溶液的是 (填编号)。
A.酸性KMnO4溶液 B.NaOH溶液 C.溴水 D.氨水
(2)石灰石-石膏湿法烟气脱硫工艺技术的工作原理是烟气中的二氧化硫与浆液中的碳
酸钙以及鼓入的空气反应生成石膏(CaSO4·2H2O)。写出该反应的化学方程式: 。
某电厂用煤300吨(煤中含硫质量分数为2.5%),若燃烧时煤中的硫全部转化成二氧
化硫,用石膏湿法烟气脱硫中有96%的硫转化为石膏,则可生产石膏 吨。
15. (10分)
(10分)
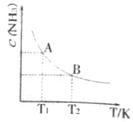
(1)在一定条件下,将1mol N2与3mol H2混合于一个10L密闭容器
中,反应在不同温度下达到平稳时NH3的浓度如右图所示。其中,
温度为T1时平稳混合气体中氨的体积分数为25%。
①当温度由T1变化到T2时,平稳常数KA KB(填“ ”、 “
”、 “ ”
”
或“=”)
②T1温度达到平衡时N2的转化率为 。
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少
量Fe2O3的TiO2)表面与水发生下列反应: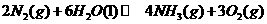
此反应的△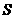 0(填“
0(填“ ”、 “
”、 “ ”或“=”) △
”或“=”) △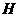 。
。
(已知: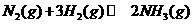 △
△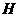 =
=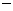 92.4kJ/mol
92.4kJ/mol
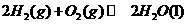 △
△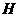 =
= 571.6kJ/mol)
571.6kJ/mol)
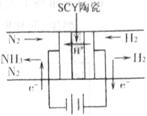 (3)科学家采用高质子导电性的SCY陶瓷(可传递H+),实现了
(3)科学家采用高质子导电性的SCY陶瓷(可传递H+),实现了
低温常压下高转化率的电化学合成氨,其实验原理如右图所
示,则阴极的电极反应式为 。
14.(10分) -锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
-锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
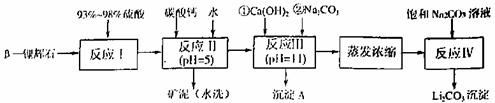
以 -锂辉石为原料制备碳酸锂的一种流程如下:
-锂辉石为原料制备碳酸锂的一种流程如下:
已知:①部分金属氢氧化物开始沉淀和完全沉淀的pH:
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
2.7 |
3.7 |
9.6 |
|
完全沉淀pH |
3.7 |
4.7 |
11 |
②Li2CO3在不同温度的溶解度如下表:
|
温度/℃ |
0 |
10 |
20 |
50 |
75 |
100 |
|
Li2CO3的溶解度/g |
1.539 |
1.406 |
1.329 |
1.181 |
0.866 |
0.728 |
回答下列问题:
(1)反应II中加碳酸钙的作用是 。
(2)写出反应III中生成沉淀A的离子方程式 、 。
(3)写出反应IV的化学方程式 。洗涤所得Li2CO3沉淀要用热水而非冷水,原
因是 。
13.(12分)黄铁矿的主要成分是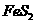 。测定黄铁矿中
。测定黄铁矿中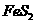 含量的两种方法如下图所示:
含量的两种方法如下图所示:

|
|

 王水
方法I
王水
方法I

 滤液
滤液
 黄铁矿
足量BaCl2溶液
黄铁矿
足量BaCl2溶液
|
 干燥、称重
干燥、称重
已知: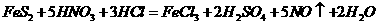
请回答下列问题:
(1)方法I中灼烧滤渣用的仪器除酒精灯、三角架、还有 。
(2)方法II中加足量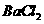 溶液的作用是 ,判断加入
溶液的作用是 ,判断加入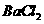 溶液已过量的操作是
溶液已过量的操作是
。
(3)用方法I测定黄铁矿试样中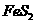 的含量,发现测定结果总是偏高,则产生误差的可能原因是:①
;② 。(测定过程中由操作产生的误差可忽略。)
的含量,发现测定结果总是偏高,则产生误差的可能原因是:①
;② 。(测定过程中由操作产生的误差可忽略。)
(4)称取黄铁矿试样1.60g,用方法II进行测定,称得干燥后的滤渣质量为1.66g,假
设矿石中的硫元素全部来自于FeS2,则该矿石中FeS2的质量分数是 。
12.25℃时,下列溶液中微粒的物质的量浓度关系正确的是
A.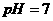 的
的 与
与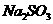 混合溶液中:
混合溶液中: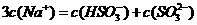
B.0.1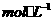 的KHA溶液,其
的KHA溶液,其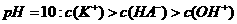
C.20mL 0.1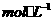 醋酸钠溶液与10mL 0.1
醋酸钠溶液与10mL 0.1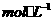 盐酸混合后的溶液中:
盐酸混合后的溶液中:
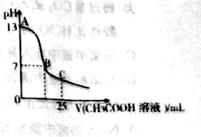

D.在25mL 0.1 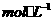
 溶液中逐滴加入0.2
溶液中逐滴加入0.2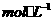
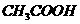 溶液,溶液pH变化如右图所示,在A、B间
溶液,溶液pH变化如右图所示,在A、B间
任一点,溶液中一定都存在下列关系:
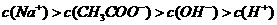
非选择题
11.芬兰籍华人科学家张霞昌研制的“超薄型软电池”或2009年中国科技创业大赛最高奖,被称之为“软电池” 的纸质电池总反应为: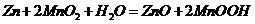 。下列说法正确的是
。下列说法正确的是
A.该电池中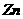 作负极,发生还原反应
作负极,发生还原反应
B.该电池反应中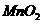 起催化作用
起催化作用
C.该电池工作时电流由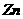 经导线流向
经导线流向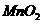
D.该电池正极反应式为: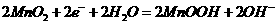
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com