
题目列表(包括答案和解析)
9.下列离子方程式正确的是
A.向水中通人氯气: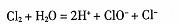
B.向明矾溶液中加过量氨水: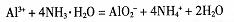
C.向Ca(:HC03)2溶液中滴加少量Na0H溶液: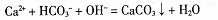
D.向Na2Fe04溶液中加入稀硫酸,迅速反应产生

8.短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为32,且原子最外层电子数之和为10;A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素。下列叙述正确的是
A.四种元素的原子半径:A>B>C>D
B.最高价氧化物对应的水化物的酸性:B>D
C.C元素处于元素周期表中第3周期第ⅡA族
D.B、D的最高价氧化物中,B、D与氧原子之间一定均为单键
7.在下列溶液中,各组离子一定能大量共存的是
A.PH=1的溶液中:
B.含有大量Fe3+的溶液中: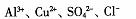
C.加入A1能放出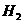 的溶液中:
的溶液中: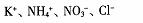
D.水电离产生的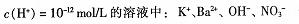
6.设NA为阿伏加德罗常数的值。下列叙述正确的是
A.0.1 mol/L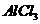 ,溶液中含有的
,溶液中含有的 数为0.3
数为0.3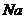
B.标准状况下,11.2 L的乙烯中含有的共用电子对数为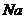
C.常温下,1 mol 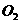 和
和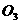 的混合气体中所含氧原子数为2.5
的混合气体中所含氧原子数为2.5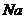
D.13.0 g锌与一定量浓硫酸恰好完全反应,生成气体分子数为0.2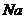
5.下列有关物质性质的叙述正确的是
A.浓硫酸能干燥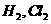 ,CO等气体,说明浓硫酸具有吸水性
,CO等气体,说明浓硫酸具有吸水性
B.乙炔能使溴水、酸性高锰酸钾溶液褪色,说明乙炔具有漂白性
C.纤维素的水解产物能够发生银镜反应,说明纤维素是还原性糖
D.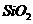 既能溶于NaOH溶液又能溶于HF溶液,说明
既能溶于NaOH溶液又能溶于HF溶液,说明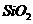 是两性氧化物
是两性氧化物
4.下列有关实验操作的叙述正确的是
A.实验室利用右图所示装置制取并收集氨气
B.用洁净的玻璃棒蘸取溶液,点在湿润的pH。试纸上测定溶液pH
C.用铂丝蘸取某溶液于无色火焰灼烧,火焰呈浅紫色,证明其中含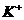
D。在苯和苯酚的混合液中加入足量的浓溴水,振荡、过滤分离出苯酚
3.在碘酸钠( )的碱性溶液中通入氯气,可以得到高碘酸钠(
)的碱性溶液中通入氯气,可以得到高碘酸钠(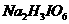 )。下列有关该反应的说法错误的是
)。下列有关该反应的说法错误的是
A.在该反应中碘酸钠作还原剂
B.碱性条件下,氯气的氧化性强于高碘酸钠
C.反应中生成1 mol 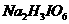 ,转移2mol电子
,转移2mol电子
 D.反应中氧化产物与还原产物的物质的量之比为2:1
D.反应中氧化产物与还原产物的物质的量之比为2:1
2.下列有关化学用语使用正确的是
A.醛基的电子式:
B.原子核内有8个中子的碳原子: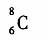
C.钾离子结构示意图: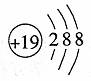
D,2-甲基一1一丙醇的结构简式: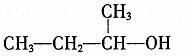
1.温家宝总理在2010年政府工作报告中提出:“要大力开发低碳技术,推广高效节能技术,积极发展新能源和可再生能源。”下列有关做法与此不相符的是
A.大力开发丰富的煤炭资源,减少对石油的依赖
B.回收废弃饮料包装纸,制作成公园内的休闲长椅
C.在西部和沿海地区兴建风力发电站,解决能源问题
D.鼓励购买小排量汽车,推广与发展电动、混合动力汽车
21.(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中一题,并在相应的答题区域作答。若两题都做,则按A题评分。
A.能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式______ 。
(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(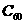 )的结构如右图,分子中碳原子轨道的杂化类型为______;1 mool
)的结构如右图,分子中碳原子轨道的杂化类型为______;1 mool 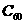 分子中
分子中 键的数目为______ 。
键的数目为______ 。
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等。
①第一电离能:As_____Se(填“>”、“<”或“=”)。
②硫化锌的晶胞中(结构如右图所示),硫离子的配位数是_______。
③二氧化硒分子的空间构型为________。
(4)金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如下图,请在下图中用箭头表示出配位键。

B.实验室甩乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表。
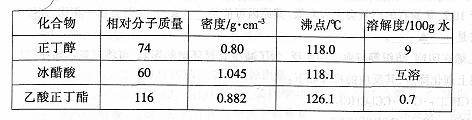
请回答有关问题。
I.乙酸正丁酯粗产品的制备在三孔圆底烧瓶中加入沸石、18.5 mL正丁醇和15.4 mL冰醋酸,再加3-4滴浓硫酸。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热使之反应。
(1)有同学拟通过某种谱线鉴定所得产物中是否含有醚类物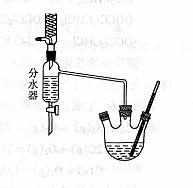 质。这种谱线为 ______。
质。这种谱线为 ______。
(2)反应时加热有利于提高酯的产率,但温度过高酯的产率反而降低,其可能的原因是______。
Ⅱ.乙酸正丁酯粗产品的精制
(1)①将圆底烧瓶中的液体转入分液漏斗中,并用饱和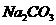 溶液洗涤有机层,该步操作的目的是
_____。
溶液洗涤有机层,该步操作的目的是
_____。
②用分液法可分离上述有机层和水层,分液完成后,取出有机层的操作是 _______
(2)将酯层进行蒸馏。蒸馏收集乙酸正丁酯产品时,应将温度控制在________左右。
Ⅲ.计算产率
称量制得的乙酸正丁酯的质量为12.76 g,则乙酸正丁酯的产率为_______

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com