
题目列表(包括答案和解析)
8.X、Y、Z、W都是短周期主族元素。其中X原子最外层电子数是内层电子总数的3倍;X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X、Y、Z三种原子的最外层电子数之和为19。下列说法正确的是
A.Y元素最高价氧化物对应水化物的化学式为:HY04
B.X、Y、Z形成的简单离子的半径大小为:Yn->Zm->Xm-
C.元素Z、Y分别与元素W形成的化合物的热稳定性为:WmZ<WnY
D.相同条件下,HnY溶液的酸性比HmZ溶液的酸性弱
7.在下列各溶液中,一定能大量共存的离子组是
A.常温下pH=7的溶液中:Fe3+、Na+、Cl-、N03-
B.常温下c(OH-)/c(H+)=1014的溶液中:K+、Mg2+、Cl-、Br-
C.含有大量HCO3-的澄清透明溶液中:K+、C6H5O-、Cl-、Na+
D.能与金属铝反应放出氢气的溶液中:K+、No3-、Cl-、Fe2+
6.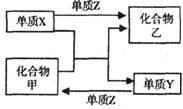 X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物。下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物。下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是
|
选项 |
X |
Y |
Z |
甲 |
乙 |
|
A |
H2 |
Si |
C12 |
SiCl4 |
HCl |
|
B |
Mg |
C |
o2 |
CO2 |
MgO |
|
C |
Zn |
Fe |
Cl2 |
FeCl2 |
ZnCl2 |
|
D |
O2 |
N2 |
H2 |
NH3 |
H2O |
不定项选择题:本题包括6小题,每小题4分,共计24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分。但只要选错一个,该小题就得0分。
5.下列装置或操作不能达到实验目的的是

4.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数为3NA
B.100 mL 18.4 mol·L-1硫酸与足量铜反应,生成S02的分子数为0.92 NA
C.1 L 0.1 mol·L-1的醋酸溶液中所含的离子和分子总数为0.1 NA
D.1.2g NaHS04晶体中阳离子和阴离子的总数为0.03 NA
3.下列说法正确的是
A.自来水厂可用硫酸铁对水进行消毒杀菌
B.工业上通过电解AlCl3饱和溶液制备金属铝
C.蛋白质、葡萄糖和脂肪都可以在人体中发生水解
D.某温度下NH3(g)+HCl(g)=NH4Cl(s)能自发进行,则其△H<0
2.下列化学用语或模型表示正确的是
A.Cl-离子的结构示意图: B.CH14分子的球棍模型:
B.CH14分子的球棍模型:
C.氢氧化钠的电子式: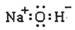 D.次氯酸的结构式:H-O-Cl
D.次氯酸的结构式:H-O-Cl
1.2010年上海世博会将实现环保世博、生态世博目标,下列做法中不符合这一目标的是
A.部分国家的展馆使用可降解的建筑材料
B.把世博会期间产生的垃圾焚烧或深埋处理
C.某些馆的外壳使用非晶硅薄膜,以充分利用太阳能
D.停车场安装了催化光解设施,用于处理汽车尾气
20.(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题作答。若两题都做,则按A题评分。
A.CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
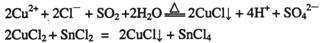
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_________。H、N、O三种元素的电负性由大到小的顺序是_____。
(2)SO2分子的空间构型为____________。与SnCl4互为等电子体的一种离子的化学式为_________。
 (3)乙二胺分子中氮原子轨道的杂化类型为_____________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_______________________________________。
(3)乙二胺分子中氮原子轨道的杂化类型为_____________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_______________________________________。
(4)②中所形成的配离子中含有的化学键类型有__________。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
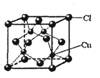
(5)CuCl的晶胞结构如右图所示,其中Cl原子的配位数为_________。
B.阿司匹林(乙酰水杨酸)是常用的解热镇痛药,以下是合成阿司匹林的工艺流程。

已知:①反应方程式为

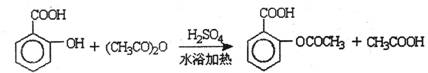
②抽滤的实验装置如右图所示。
请回答有关问题:
(1)仪器A的名称是_____________。
(2)在步骤②中,若冷却结晶时未出现结晶,可以___________,促使晶体析出。
(3)实验时,当仪器B中液面高度快达到支管口位置时,应进行的操作是____________________________________________。
(4)仪器C中两玻璃导管的位置是否正确?答:_________。(填“正确”或“不正确”)
(5)在步骤④中,用饱和NaHC03溶液可以将阿司匹林和剐产物等分离,其化学原理是
_________________________________________。要检测产品中是否含有水杨酸,其实验操作是_____________________________________________________。
(6)在步骤⑤中,搅拌使反应充分进行至_____________为止。
(7)若实验得到2.70g纯净的阿司匹林,则产品的产率为____________。
苏北四市2009-2010学年度高三第二次调研考试
19.(10分)草酸(H2C2O4)是一种重要的化工原料。已知常温下0.01 mol·L-1的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示。
|
|
H2C2O4 |
KHC2O4 |
K2C2O4 |
|
pH |
2.0 |
3.1 |
8.1
、 |
(1)在其它条件不变时,下列措施能使KHC2O4溶液中c(K+)∶c(HC2O4-)接近1∶1的是_________(填字母)。
A.加入适量的H2C2O4 B.加入适量的KHC2O4
C.加入适量的Na2C2O4 D.升高溶液的温度
(2)取一定质量H2C2O4·2H2O和KHC2O4的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-1 NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol·L-1 H2SO4溶液酸化后,用0.10mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
①完成离子方程式:5C2O42-+2Mn04-+16H+ =10______+2Mn2++8H2O。
②原混合物中H2C2O4·2H2O和KHC2O4的物质的量之比为__________。
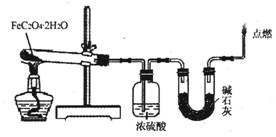
(3)某实验小组用如图所示的装置探究FeC2O4·2H2O在隔绝空气条件下受热分解的产物。当36.0g FeC2O4·2H2O充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g。求残留固体的成分和物质的量。(已知FeC2O4·2H2O的相对分子质量为180;设反应产生的气体被充分吸收)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com