

题目列表(包括答案和解析)
25.(1)Fe+ H2SO4= FeSO4+ H2 ↑ (2分)
FeSO4 +(NH4)2SO4 + 6H2O =(NH4)2Fe(SO4)2·6H2O(2分)
(2)解:设生成(NH4)2Fe(SO4)2·6H2O的物质的量为xmol。由上述方程式知:
H2SO4~FeSO4 ~ (NH4)2Fe(SO4)2·6H2O
1mol 1mol
15×3×10-3mol xmol
x=0.045
生成(NH4)2Fe(SO4)2·6H2O的质量为:0.045mol×392g/mol=17.64g(2分)
(3)①5、1、8、1、5、4 H2O(2分) ②83.33%。(2分)
24.(每空2分,共14分)
(1)2C4H10+13O2=8CO2+10H2O (2)O2+2CO2 +4e-=2CO32-
(3)CO2 负极反应产物
(4)①2Cl-+2H2O Cl2↑+H2↑+2OH- ②5Cl2+I2+6H2O=10HCl+2HIO3 ③560
Cl2↑+H2↑+2OH- ②5Cl2+I2+6H2O=10HCl+2HIO3 ③560
23.(每空2分,共12分)
(1)A:Si,B:Mg (2)抑制氯化镁水解
(3)①Si+2NaOH+H2O Na2SiO3+2H2↑
|
④SiO2+Na2CO3 Na2SiO3+CO2↑
22.(每空2分,共12分)
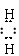
(1)H3O+ [H N H]+ (2)> (3)Al3++3NH3·H2O = Al(OH)3↓+3NH4+
(4)NH4Al(SO4)2 (5)336
21.(12分)
(1)B中装无水硫酸铜,检验水蒸气; C中装澄清的石灰水,检验二氧化碳;(每空1分)
(2)验纯后点燃E处的气体,火焰呈蓝色。(2分,不答“验纯”扣1分)
(3)点燃前应验纯;CO有毒,实验要通风;加热时要均匀受热等。(2分)
(4)挥发出来的草酸蒸气与石灰水反应生成了草酸钙沉淀,会干扰CO2的检验(2分) 在装置B和C装置间增加一个装有水(或烧碱溶液)的洗气装置反应(2分)
1.D 2.C 3.C 4.B 5.C 6.C 7.D 8.D 9.C 10.C 11.B 12.C 13.C 14.C 15.D 16.C 17.B 18.D 19.B 20.A
25.(10分)过量的铁溶于稀硫酸可得硫酸亚铁。等物质的量的硫酸亚铁与硫酸铵作用,能生成溶解度较小的硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O,浅绿色晶体],该晶体的商品名称为摩尔盐。
(1)写出上述反应的化学方程式。
(2)若用15mL 3mol/L硫酸来制备摩尔盐,计算生成摩尔盐的质量。
(3)为了测定某批次莫尔盐的纯度,取该产品23.52g,配成100 mL溶液,取出10mL用0.10 mol/L KMnO4溶液滴定,消耗KMnO4溶液10.00mL。
①配平下列反应式:
Fe2++ MnO4-+ H+ - Mn2++ Fe3++
②试求产品中莫尔盐的质量分数 。
|
24.(14分)熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO32--52e-=34CO2+10H2O。试回答下列问题:
(1)该燃料电池的化学反应方程式为 ;
(2)正极电极反应式为 。
 (3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是
,它来自
。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是
,它来自
。
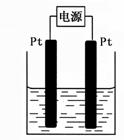
(4)某学生想用该燃料电池和右图所示装置来电解饱和食盐水。
① 写出反应的离子方程式 。
② 将湿润的淀粉KI试纸放在该装置附近,发现试纸变蓝,待
一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。
若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的
化学方程式为 。
③ 若电解后得到200mL 3.25mol/LNaOH溶液,则消耗C4H10 的体积在标准状况下为 mL。
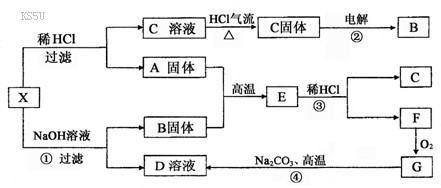
23.(12分)下图中X为中学化学中两种重要的短周期元素组成的单质的混合物。A、G均为原子晶体,F是正四面体结构的非极性分子,反应②、④是工业上的重要反应。图中部分反应的生成物及反应条件没有列出。
请回答:
(1)写出A和B的化学式:A ,B 。
(2)写出C溶液转化为C固体的过程中HCl气流的作用是
(3)写出①、③和④反应的化学方程式:
①
③
④
22.(12分)X、Y、Z是阳离子,K是阴离子,M、N是中性分子。它们都由短周期组成,且具有以下结构特征和性质:
①它们核外电子总数都相同;
②N溶于M中,滴入酚酞,溶液变红;
③Y和K都由A、B两元素组成,Y核内质子总数比K多两个;
④X和N都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和K的浓溶液在加热情况下生成M和N;
⑥Z为单核离子,向含有Z的溶液中加入少量K溶液,有白色沉淀生成,再加入过量的K或Y的溶液,沉淀消失。
试完成下列各题:
(1)Y的化学式为 ;X的电子式为 ;
(2)试比较M和N的稳定性:M N;
(3)写出Z和N的水溶液反应的离子方程式 ;
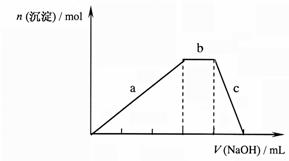 (4)上述六种微粒中的两种可与
(4)上述六种微粒中的两种可与
硫酸根形成一种复盐,向该盐的浓溶
液中逐滴加入0.1mol/L的NaOH溶液,
出现了如右图中a、b、c三个阶段的
图象,根据图象判断该盐的化学式为
。
(5)将1.92g铜投入到一定量由A、B、C三种元素形成的一种常见化合物的溶液中,共收集到672mL气体(标准状况下),将盛有此气体的容器倒扣在水槽中,通入一定量的氧气,恰好使气体完全溶于水,则通入氧气在标准状况下的体积是 mL。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com