
题目列表(包括答案和解析)
13.某有机物分子中含n个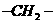 ,m个
,m个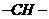 ,a个
,a个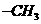 ,其余为
,其余为 。则
。则 的个数为
的个数为
A.m+2-a B.2n+3m-a C.m+n+a D.m+2n+2-a
12.在体积均为1L,pH均等于2的盐酸和醋酸溶液中,分别投入0.23g Na,则下图中符合
反应事实的曲线是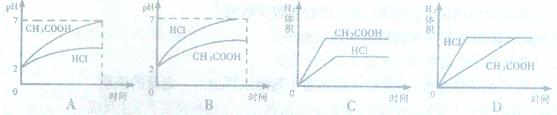
11.某溶液中只可能含有下列离子中的几种(不考虑溶液中含的较少的H+和OH-Na+
NH4+、S042-、CO2-、N03-。取200ml该溶液,分为等体积的两份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL。实验2:第二份先加入足量的盐酸,无现象,再加足量的BaCl2溶液,得固体2.33g。下列说法正确的是
A.该溶液中可能含有Na+ B.该溶液中肯定含有NH4+、S042-、CO32-,N03一
C.该溶液中一定不含N03+D.该溶液中一定含Na+,且c(Na+)≥0.1 mol/I
9.阿伏加德罗常数为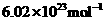 ,下列叙述不正确的是
,下列叙述不正确的是
①60g石英晶体中含有的Si-O键数是4×6.02×1023
②电解精炼铜的过程转移6.02×1023电子时,阳极溶解32g铜 ,
③7.8g Na2S和Na202的混合物中含有的阴离子数大于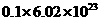
④2mol SO2和1mol O2混合,在V2O5催化作用下于密闭容器中加热反应后,容器内的分子数大于2×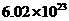
⑤2.9g熟石膏(2Ca804·H20)含有结晶水的分子数为0.02×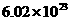 (2CaS04
(2CaS04 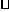 H220
H220
的相对分子质量为290)
⑥含0.2mlS04的浓硫酸与足量铜反应,生成S02的分子数为0.1×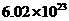
A.①②③④⑤ B.①③④⑤⑥ C.②③⑤⑥ D.③④⑤⑥
9.某密闭容器中充人等物质的量的气体A和B,在一定压强和温度下发生反应
A(g)+xB(g)  2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反
应速率随时间变化的曲线如下图所示。下列说法中正确的是
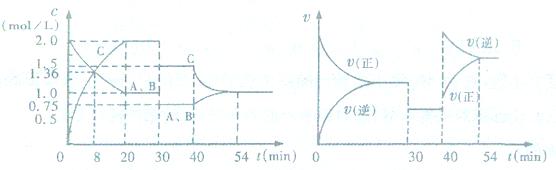
A.30min时降低温度,40rain时升高温度
B.0~8min内A的平均反应速率为0.08mol/(L·min)
C.反应方程式中的x:l,正反应为吸热反应
D.54rain时C的体积分数大于40min时c的体积分数
8.下列叙述,正确的是
A.读取滴定管内液体的体积,俯视读数导致读数偏小
B。NaOH溶液可保存在玻璃塞的试剂瓶中
C.一学生用pH试纸测得某氯水的pH为2
D.配制硫酸亚铁溶液,是将绿矾晶体溶于蒸馏水再加入一定量的铁粉
7.下列化学方程式错误的是
A.Mg3N2+6HCI(过量) 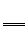 3MgCl2+2NH3↑
3MgCl2+2NH3↑
B.2KMn04十HCOOK+3KOH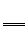 2K2Mn04十KC03十2H20
2K2Mn04十KC03十2H20
C.C2H5OH 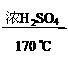 CH2=CH2↑十H2O
CH2=CH2↑十H2O
D.K2Cr207 +6FeS04+7H2S04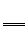 Cr2(SO4)3+3Fe2(S04)3+K2S04十7H20
Cr2(SO4)3+3Fe2(S04)3+K2S04十7H20
6.化学与生活、社会密切相关。下列说法正确的是
A.用NaOH溶液雕刻工艺玻璃上的纹饰
B.Na20可用于呼吸面具中作为氧气的来源
C.工业上硝酸可用于制化肥、农药、炸药和染料等
D.向煤中加入适量CaS04,可大大减少燃烧产物中S02的量。
25.(14)某校活动小组用下图所示装置及所给药品(图中夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知C中的浓硫酸含溶质m mol,浓硫酸易和SO3形成H2SO4. SO3 , 假设气体进入C和D时分别被完全吸收,且忽略装置内空气中的CO2。
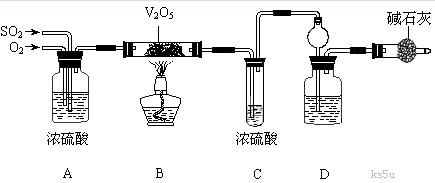
请回答下列问题:
(1)已知0.5 mol SO2被O2氧化成气态SO3,放出49.15 kJ热量,反应的热化学方程式为______________________________________________。
(2)检查完装置的气密性,加入药品开始实验,此时首先应进行的操作是________________。
(3)实验时A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是 ;装置C中浓硫酸的作用为 ;装置D中盛放的溶液是足量的 (选填字母)。
a. BaCl2溶液 b. NaOH溶液 c. NaHSO3饱和溶液
(4)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是 。
26(12) 已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一氧化还原反应的体系中,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该氧化还原反应的体系中,还原剂是______,化合价没有发生变化的反应物是___ 。
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平):
________________________________________________________。
(3)上述反应中,1 mol氧化剂在反应中转移的电子为_______ mol。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变为紫红色,BiO3-反应后变为无色的Bi3证明NaBiO3的一个性质是:_______________________________________。
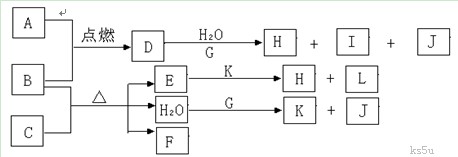
回答下列问题: (1)J的结构式为 。 (2)K的电子式为 ,属于 晶体,所含的化学键有 。 (3)若D的水溶液呈黄色,沉淀H的化学式为 。 (4)若D的水溶液呈蓝色,B与C反应的化学方程式为 。 (5)G与H2O反应的离子方程式为 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |