
题目列表(包括答案和解析)
28.已知: 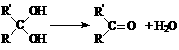
芳香烃A能发生下面一系列化学反应:
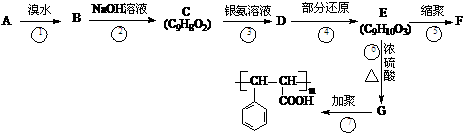
请回答下列问题:
(1)写出下列物质的结构简式:A _______, G _________;
(2)写出下列反应的反应类型:③_______,⑥_______;
(3)书写下列反应的化学方程式:
①_________________________________________________
⑤__________________________________________________
27.某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。”为此,他们设计了如下图所示的装置。
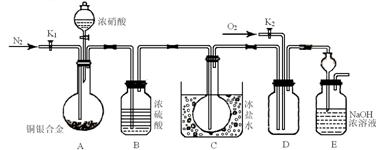
请回答下列问题
(1) 实验开始前先打开A部分的活塞K1,持续通入一段时间的氮气再关闭K1,其目的是 ;装置中B瓶的作用是 。
(2)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是 ;实验发现,通入的O2温度高低对实验现象有较大影响,为便于观察应通入(填“热”或“冷”) 的O2。
(3)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5 mol/L;实验后A中溶液:V=40mL c(H+)=1.0 mol/L。假设反应中HNO3既无挥发也无分解,则
①参加反应的HNO3的物质的量为 mol。
②若已测出反应后E装置的生成物中含氮元素的质量,则为确定合金中Cu的质量分数是否还需要测定其它实验数据? (填“是”或“否”;填“是”的回答后续问题,填“否”则不需回答);若需要,则还需测定的数据是: 。
③为减小实验误差,在A中反应完成和D中出现现象后,还应继续进行的操作是
。
(4)若已知Cu、Ag合金的质量为m g,且溶解完全。请利用A装置中反应后的溶液进行简单的操作,以确定合金中Cu的质量分数。需加入的试剂是 溶液,其操作过程为 。
26.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
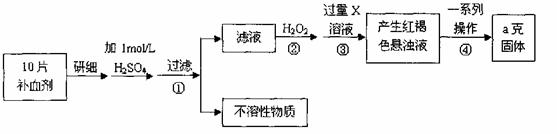 请回答下列问题:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
(2)步骤②加入过量H2O2的目的: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需 。
②滴定到终点时的颜色为 色。
(7)正常人每天应补充14mg左右的铁,其中绝大部分来自于食物。如果全部通过服用含FeSO47H2O的片剂来补充铁,则正常人每天需服用含 mg FeSO4·7H2O的片剂。
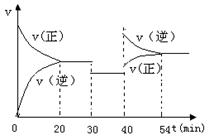
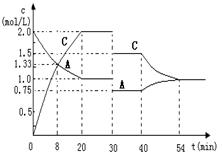
25.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g) 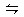 2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。
2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。
请回答下列问题:
(1)0-20min,A的平均反应速率为 ;8min时,v(正) v(逆)(填:>、=或<)
(2)反应方程式中的x= ,30min时改变的反应条件是 。
(3)该反应的正反应为 (填:“放热”或“吸热”)反应。
24.(1)请将6种物质:Fe3O4 、HNO3 、Fe(NO3)3、Fe(NO3)2、N2O分别填入下面对应的横线上,组成一个未配平的化学方程式。
_________+__________ →_________ + + +H2O
(2)发生氧化反应的反应物是__________,被还原的元素是_________。
(3)反应中1 mol氧化剂_______(填“得到”或“失去”)___________ mol电子。
(4)如果反应中使用过量的硝酸(假设硝酸的还原产物全部是N2O),请将反应物的化学式及配平后的系数填入下列相应的位置中:
_____( )+ _____( ) →
23.四种短周期元素的性质或结构信息如下表,请根据信息回答下列问题:
|
元素符号 |
元素性质或结构信息 |
|
A |
其氧化物是汽车尾气的主要有害成分之一,也是空气质量预报的指标之一 |
|
B |
原子半径是短周期主族元素中最大的 |
|
C |
地壳中含量最多的金属元素 |
|
D |
原子核外有五种不同能量的电子,且最外层有2个未成对电子 |
(1)写出A原子核外电子排布的轨道表示式 ;B原子的电子排布式为
(2)写出A形成气态氢化物的电子式 ,实验室检验该气体的方法是 。
(3)对于D元素的单质或化合物叙述一定正确的是( )
A.单质不溶于任何溶剂 B.其最高价氧化物的水化物不一定为弱酸
C.其气态氢化物不稳定 D. 最高价氧化物的晶体为分子晶体
(4)B、C两元素金属性较强的是 (写元素符号),写出证明这一结论的一个实验事实
22.amolFeS与bmolFeO投入到V L、c mol•L-1的硝酸溶液中恰好充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中被还原的硝酸可能为
A.(a+b)×63g B.21(9a+b)g C.(a+b)mol D.[Vc -3(a+b)]mol
第II卷 (共84分)
21.如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是
A.湿润淀粉KI试纸未变蓝说明SO2的氧化
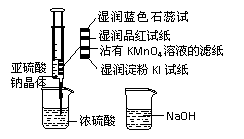 性弱于I2
性弱于I2
B.沾有KMnO4溶液滤纸、湿润的品红试纸
均褪色证明了SO2漂白性
C.湿润的蓝色石蕊试纸先变红后褪色
D.NaOH溶液可用于除去实验中多余的SO2
20.将0.2mol/LHCN溶液和0.1mol/LNaOH溶液等体积混合后,溶液显碱性,下列关系式中不正确的是:
A.C(HCN)< C(CN-) B.C(Na+) > C(CN-)
C.C(HCN)- C(CN-)= 2C(OH-)-2(H+) D.C(HCN)+ C(CN-)= 0.1mol/L
19.下列反应的离子方程式中,正确的是:
A.向苯酚钠溶液中通入少量的二氧化碳:CO2+H2O +C6H5O- → C6H5OH +HCO3-
B.向氯化铝溶液中加入过量氢氧化钠溶液:Al3+ + 4OH- → AlO2- + 2H2O
C.硫酸亚铁溶液中加入酸化的双氧水:Fe2+ + 2H+ + H2O2 → Fe3+ + 2H2O
D.氯化亚铁溶液中通入硫化氢气体:Fe2+ + H2S → FeS↓ + 2H+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com