
题目列表(包括答案和解析)
12.下列说法正确的是 
A.0.2 mol/L NH4NO3 和 0.l mol/L NaOH 溶液等体积混合后:
c(NH4+) > c (NO3- ) > c (Na+) > c (OH-) >c (H+)
B.pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后的溶液中:
c(Na+)> c(CH3COO-)
C.浓度分别为0.1 mol·L-1和0.01 mol·L-1的CH3COOH溶液中:CH3COO﹣离子浓度
前者是后者的10倍
D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:
c(CH3COOH)+2 c (H+) = c(CH3COO-)+2 c (OH-)
11.对于平衡体系mA(g)+nB(g) pC(g)+qD(g);△H<0。下列结论中不正确的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B 的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a mol
D.若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
pC(g)+qD(g);△H<0。下列结论中不正确的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B 的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a mol
D.若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
10.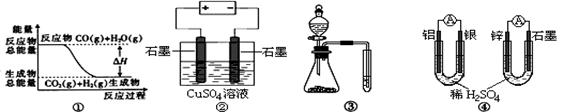 关于下列图示的说法中不正确的是
关于下列图示的说法中不正确的是
A.图①表示可逆反应“CO(g) + H2O(g) CO2(g)+H2(g)”中的ΔH<0
CO2(g)+H2(g)”中的ΔH<0
B.图②所示的装置通过标准状况阳极产生的气体体积这一条件,可以计算出原溶液中的c (Cu2+)
C.图③实验装置可完成比较乙酸、碳酸、苯酚酸性强弱的实验
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不相等
9.下列叙述正确的是
①硫酸钡难溶于水和酸,可做X光透视肠胃的药剂
②蛋白质遇酒精会变性,医疗中用75%的乙醇溶液进行消毒
③棉花、蚕丝、人造羊毛的主要成分都是纤维素
④加酶洗衣粉是在洗衣粉中加入能使蛋白质水解的碱性蛋白酶,为了提高它的活性,洗衣服时温度越高效果越好
⑤碳酸钠、氢氧化钠、碳酸钙、碳酸氢钠等都可以中和酸,故都可以作为治疗胃酸过多的药物
⑥明矾净水利用了胶体的性质 ⑦氢氟酸储存在玻璃瓶中
⑧可以用二氧化硅和水反应制备硅酸胶体
A.①②③⑦ B.①②⑥ C.①③④⑧ D.全都正确
8.A、B、C为短周期中原子序数依次增大的三种主族元素,已知C的核内质子数为A、B之和,B的K、L两层电子数之差等于A核外电子数的两倍。下列说法中正确的是
A.A、B、C所组成的单质晶体类型不可能相同
B.由A、B、C三种元素所组成的化合物相对分子质量最小为31
C.A与B、A与C所组成的晶体类型不相同
D.A与B、A与C所形成的最简单分子前者是非极性分子,后者为极性分子
7.下列离子方程式正确的是
A.等物质的量的Ba(OH)2与明矾加入足量水中:
3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
B.Fe(OH)3溶于氢碘酸: Fe(OH)3+3H+= Fe3++3H2O
C.向小苏打溶液中加入过量的石灰水:
Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
D.将AlCl3溶液蒸干:Al3++3H2O Al(OH)3+3H+
Al(OH)3+3H+
6.NA代表阿伏加德罗常数,下列说法正确的是
A.标准状况下,2.24L溴乙烷中含有的溴离子数目为0.1×6.02×1023
B.25℃时,l L pH=13的Ba(OH)2 溶液中含有OH―的数目为0.1 NA
C.31g白磷中含有NA个共价键
D.1L0.5mol·L-1CuCl2溶液中含有的Cu2+数目为0.5×6.02×1023
30.(16分)以 HCHO 和 C2H2为有机原料,经过下列反应可得化合物 N(C4H8O2)。
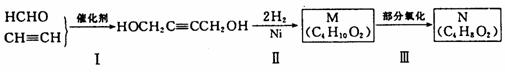
(1)反应Ⅰ的反应类型为_______________。
(2)HOCH2C≡CCH2OH分子中,在同一个平面的原子最多有________个。
(3)化合物M不可能发生的反应是_____________(填序号)。
A.氧化反应 B.取代反应 C.消去反应 D.加成反应 E.还原反应
(4)N的同分异构体中,含有两个甲基且属于酯类的有___________种。
(5)A与M互为同分异构体,有如下转化关系。
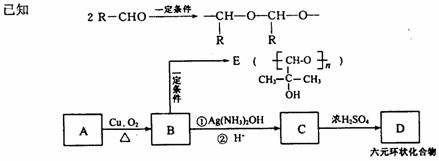
填写下列空白:
①A的结构简式为_______________,C生成D的反应类型是_______________
②D的化学式为_______________________
③写出B与银氨溶液反应的化学方程式:_______________________________
④在120℃时,由A、B、E组成的混合物wg与氧气充分反应,生成产物全部为气体时,消耗氧气质量[m(O2)]的范围为________________________。
29.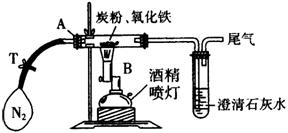 (17分)某校研究性学习小组对过量炭粉与氧化铁反应产物中气体的成分进行研究。
(17分)某校研究性学习小组对过量炭粉与氧化铁反应产物中气体的成分进行研究。
(1)提出假设:该反应的气体产物全部是二氧化碳。
(2)设计方案:将一定量的氧化铁在隔绝氧气条件下与过量炭粉完全反应(如右图),测定参加反应的碳元素与氧元素的质量比。
(3)查阅资料:氮气不与炭粉、氧化铁发生反应,可用来隔绝氧气。实验室可以用氯化铵饱和溶液和亚硝酸钠饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式:__________________________。
(4)实验操作:
|
操作步骤及实验现象 |
简答 |
|
①称取3.2 g氧化铁与2
g炭粉均匀混合,放入48.48 g的玻璃管中,按如图装置连接 |
- |
|
②加热前,先通一段时间纯净、干燥的氮气 |
其目的是:________________________ |
|
③夹紧T处弹簧夹,加热一段时间,澄清石灰水变浑浊 |
该现象说明:_____________________ |
|
④完全反应后,冷却至室温,称得玻璃管和固体的总质量为52.24 g |
- |
(5)数据处理:经计算,参加反应的碳元素质量为 g。
(6)得到结论:根据数据处理结果,得出原假设不成立,理由是:_________________
_____________________________________________。
(7)根据数据处理结果,反应生成的气体是______,该实验的化学方程式为:__________________________________________。
(8)该实验设计存在不合理之处,请指出并说明改进方法 。
28.(14分)A、B、C、X是中学化学常见物质,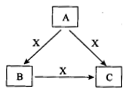 均由短周期元素组成,转化关系如图所示。请针对以下三种不同情况回答:
均由短周期元素组成,转化关系如图所示。请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀
①A中含有的金属元素为___________。
②该金属元素的单质与某氧化物在高温下反应,可用于焊接铁轨及定向爆破,反应的化学反应方程式为_______________________________。
(2)若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8e 结构。
结构。
①B的电子式为_____________。
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为_____________ 。
。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①A中所含有的化学键是_____________。
②将4.48 L(标准状况下)X通入100mL 3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为_______________________________________。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com