
题目列表(包括答案和解析)
10.通过实验、观察、类比、推理等方法得出正确的结论是化学学习的方法之一。
对下列反应的推断或解释正确的是
|
|
操作 |
可能的实验现象 |
解释 |
|
A |
某溶液中加入硝酸酸化的氯化钡溶液 |
有白色沉淀生成 |
溶液中一定含有SO42- |
|
B |
向CaSO3中加入硝酸 |
有刺激性气味的气体生成 |
CaSO3与硝酸反应生成SO2 |
|
C |
同温同压下用pH试纸测定相同浓度的碳酸钠和硫酸钠溶液的酸碱性 |
碳酸钠溶液显碱性,硫酸钠溶液显中性 |
碳酸钠溶液发生了水解 |
|
D |
向淀粉KI溶液中通入Cl2 |
溶液变蓝 |
Cl2与淀粉发生显色反应 |
9.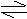 25℃时,水的电离达到平衡:H2O H+ + OH- △H>0,下列叙述正确的是
25℃时,水的电离达到平衡:H2O H+ + OH- △H>0,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,KW增大,pH不变
8.若NA表示阿伏加德罗常数,下列说法中正确的是
A. 标准状况下,1.12 L 水中含有的分子数约为62.2 NA
B. 常温下,5.6 g 铁钉与足量浓硝酸反应,转移的电子数为0.3 NA
C. 1L 0.5 mol·L-1 Na2CO3溶液中,阴阳离子总数为1.5 NA
D. 1 mol H2O2含有极性共价键为NA,含有非极性共价键为 2 NA
7.在PH=13的无色溶液中,可以大量共存的一组离子是
A. NH4+ 、NO3- 、K+、SO42- B. CO32- 、NO3- 、HCO3- 、Na+
C. Na+ 、ClO- 、AlO2- 、NO3- D. MnO4- 、K+ 、Na+ 、SO42-
6.化学与生活是紧密相联的,下列说法正确的是
A.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰
B.海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化
C.生铁在潮湿的空气中易生锈,其负极反应式为2H2O + O2 + 4e- = 4OH-
D.现用清洁燃料主要有压缩天然气和液化石油气两类,他们均属于碳氢化合物
30.(16分)乙基香草醛(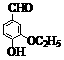 )是食品添加剂的增香原料,其香味比香草醛更加浓郁。
)是食品添加剂的增香原料,其香味比香草醛更加浓郁。
(1)写出乙基香草醛分子中两种含氧官能团的名称_______________________。
(2)乙基香草醛的同分异构体A是一种有机酸,A可发生以下变化:
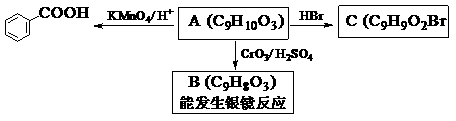
提示:①RCH2OH RCHO;
RCHO;
②与苯环直接相连的碳原子上有氢时,此碳原子才可被酸性KMnO4溶液氧化为羧基。
(a)由A→C的反应属于_______________(填反应类型)。
(b)写出A的结构简式________________________。
(3)乙基香草醛的另一种同分异构体D(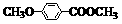 )是一种医药中间体。请设计合理方案用茴香醛(
)是一种医药中间体。请设计合理方案用茴香醛(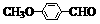 )合成D(其他原料自选,用反应流程图表示,并注明必要的反应条件)。
)合成D(其他原料自选,用反应流程图表示,并注明必要的反应条件)。
例如: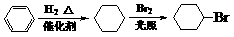
(4)请写出乙基香草醛符合以下条件的同分异构体的种类数__________(填数字)。
①含苯环,有两个对位的取代基;②能发生银镜反应,能使Fe3+溶液变紫色;③属于酯类。
29. (14分)纯碱是工业生产和日常生活中的重要物质。某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究。请填空:
(14分)纯碱是工业生产和日常生活中的重要物质。某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究。请填空:
方案一:纯碱样品 测定剩余固体质量
测定剩余固体质量
(1)分别称取干燥坩埚和纯碱样品的质量,将纯碱样品放入坩埚中充分
加热(如右图)。坩埚中发生反应的化学方程式为
(2)将坩埚置于干燥器中冷却后称量。实验时需要重复“加热一冷却一
称量”操作多次,其目的是 。
方案二:纯碱样品溶液 测定沉淀质量
测定沉淀质量
(3)称取m 1g样品,置于小烧杯中,加水溶解。向小烧杯中滴加足量
氯化钙溶液。将反应混和物过滤后的下一步操作是
(4)沉淀经干燥后称量为m 2g,则该样品中碳酸钠的质量分数为
(5)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的
情况下,测得样品中的碳酸钠质量分数将比实际 (填“偏高”、“偏低”或“不变”)。
方案三:纯碱样品 测定生成CO2的质量
测定生成CO2的质量
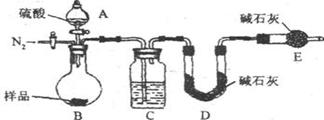
(6)反应前后都要通入N2,反应前通入N2的目的是
(7)如果没有干燥管E,在其他操作正确的情况下,测得样品中的碳酸钠质量分数将比实际 (填“偏高”、“偏低”或“不变”)
28.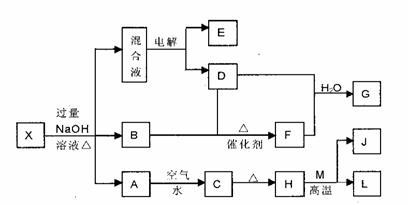 (15分)有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物从略)。其中B、D、E、F均为无色气体,M、L为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和M反应可放出大量的热。
(15分)有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物从略)。其中B、D、E、F均为无色气体,M、L为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和M反应可放出大量的热。
请回答下列问题:
(1)物质X的化学式为
(2)电解混合液时阳极反应式为
(3)按要求写出上述转化关系中有关反应的化学方程式:
①含有L元素的化合反应
②含有L元素的置换反应
(4)L与过量G的稀溶液反应的离子方程式为
(5)已知a g E气体在D中完全燃烧生成稳定的化合物时,放出b kJ的热量,写出E燃烧热的热化学方程式
27.(15分)请按要求回答问题:
Ⅰ.(5分)X、Y、W、Q都是短周期元素,已知Y、X、W、Q的原子半径依次增大,X、Y同周期,X、W同主族,W原子核内的质子数等于X、Y原子核内的质子数之和,W原子最外层的电子数是Q原子最外层电子数的3倍
试回答下列问题:
(1)Y、W、Q三种元素形成的简单离子的半径由大到小的顺序是(元素符号表示) 。
(2)仅由Y、W两元素组成的阴离子的水解方程式 。
Ⅱ.(5分)在25℃时,用石墨电极电解100mL 1mol·L-1 AgNO3溶液,如有0.2mol电子发生转移,试回答下列问题:
(1)阴极上发生的电极反应为 ;
(2)标准状况下反应共产生的气体体积为 。
Ⅲ.(5分)钢铁“发蓝”是在钢铁表面形成一层致密的Fe3O4薄膜的技术。其中一种方法是将钢铁制品浸到NaNO2和浓NaOH的混合溶液中加热到130℃。其过程可以用如下化学方程式表示:
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑+7NaOH
③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
则反应②中的氧化剂是 (填化学式),整个反应过程中,每有168 g Fe参加反应,则转移 mol电子。
13.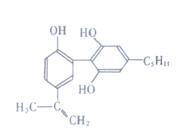 “人文奥运”的一个重要体现就是禁止运动员服用兴奋剂。有一种兴奋剂的结构简式如下式,有关该物质的说法正确的是:
“人文奥运”的一个重要体现就是禁止运动员服用兴奋剂。有一种兴奋剂的结构简式如下式,有关该物质的说法正确的是:
A.该分子中所有碳原子可以稳定的共存在一个平面中
B.1mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的
量分别为4mol、7mol
C.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
D.滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在双键
第Ⅱ卷
用0.5mm的黑色签字笔或黑色墨水钢笔直接答在答题卡上。答在试题卷上无效。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com