
题目列表(包括答案和解析)
25.(16分)硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定
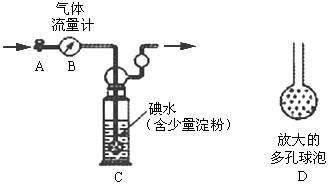
体积已知浓度的碘水中测定二氧化硫的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:
。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种: 。
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量
(填“偏高”、“偏低”或“无影响”)。
乙方案:实验步骤如以下流程图所示:
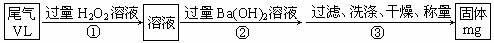
(4)写出步骤②中反应的化学方程式 。
(5)步骤③中洗涤沉淀的方法是 。
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)为 (用含有V、m的代数式表示)。
丙方案:将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,其余步骤与方案乙相同。
(7)你认为丙方案是否合理,说明理由:
。
选考部分
24.(15分)一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
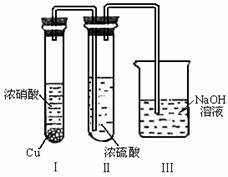
(1)一定温度下,向某密闭容器中加入足量铁粉并
充入一定量的CO2气体,反应过程中CO2气体和
CO气体的浓度与时间的关系如图所示,求8分钟
内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,则CO2的转化率将
(填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeSO4溶液与稍过量的NH4HCO3溶液混合,可得含FeCO3的浊液。若FeCO3浊液长时间暴露在空气中,固体表面会变为红褐色,写出由FeCO3生成红褐色物质的反应的化学方程式: 。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g)+O2(g)==2CO2(g) △H=-566 kJ/mol;2H2(g)+O2(g)==2H2O(g) △H=-483.6 kJ/mol。写出CO和H2O(g)作用生成CO2和H2的热化学方程式
。
23.(14分)短周期常见元素形成的纯净物A、B、C、D、E转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。

请回答下列问题:
Ⅰ.若A为金属,C是离子化合物,D是一种常见的强碱。
(1)写出A的离子结构示意图 。C的化学式 。
 (2)D与等物质的量醋酸反应所得溶液的PH__________7,(填“>”,“<”,“=”)。原因是(用文字和离子方程式说明)
(2)D与等物质的量醋酸反应所得溶液的PH__________7,(填“>”,“<”,“=”)。原因是(用文字和离子方程式说明)
。
Ⅱ.若C是一种气体,D是一种强酸,则:
(3)C与水反应的化学方程式为
。
(5)有人认为“浓H2SO4可以干燥气体C”。
某同学为了验证该观点是否正确,用右图装置
进行实验。实验过程中,浓H2SO4中未发现有
气体逸出,且变为红棕色,则你得出的解释和
结论是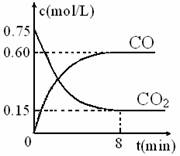
。
12.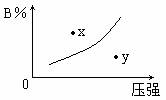 反应mA(s)+nB(g)
反应mA(s)+nB(g)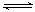 pC(g) △H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
pC(g) △H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
① m+n>p;② x点表示该反应的正反应速率大于逆反应速率;
③ n>p; ④ x点时比y点时的反应速率慢。
A.只有① B.只有②④ C.只有①②④ D.只有①和③
第Ⅱ卷(非选择题共58分)
必考部分共3题,共45分。
11.1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH 4Na+O2↑+2H2O;后来,盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:
4Na+O2↑+2H2O;后来,盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:
 3Fe+4NaOH
3Fe+4NaOH 4Na↑+2H2↑+Fe3O4。下列有关说法正确的是( )
4Na↑+2H2↑+Fe3O4。下列有关说法正确的是( )
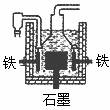
A.电解熔融氢氧化钠制钠,阳极发生的电极反应为:
2OH――2e―== H2↑+O2↑
B.盖·吕萨克制钠证明铁的还原性比钠强
C.若用戴维法与盖·吕萨克法制得等量的钠,则两反应各自
转移的电子数相同
D.电解熔融氢氧化钠制钠的电解槽中(如右图),石墨为阳极,铁为阴极
10.下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的是( )
A.由水电离的C(H+):①=②>③=④
B.将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:②>③
C.向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>①>②
D.等体积的①、②、④溶液分别与铝粉反应,生成H2的量:②最大
9.下列应用化学科学对物质进行研究的基本方法或所得的结论,不正确的是( )
A.焰色反应实验,若火焰呈黄色,不能确认是否含有钾元素
B.根据CO2和SiO2都是酸性氧化物,推知两者物理性质相似
C.根据电解质在水溶液中能否完全电离,将电解质分为强电解质与弱电解质
D.测定物质的量浓度相同的NaA和NaB溶液的PH,可以比较对应酸的酸性强弱
8.下列反应的离子方程式书写正确的是( )
A.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+==2Fe3++2H2O
B.以石墨作电极电解氯化铝溶液:2Cl- + 2H2O 2OH-
+ H2↑+ Cl2↑
2OH-
+ H2↑+ Cl2↑
C.浓烧碱溶液中加入铝片:Al + 2OH-== AlO2- + H2↑
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:2H++SO42 -+Ba2++2OH-==BaSO4↓+2H2O
7.下列说法正确的是( )
A.汽油和植物油都是碳氢化合物
B.通过煤的干馏、液化和气化,可获得洁净的燃料
C.苯能与溴水发生取代反应而使其褪色
D.甲烷、乙烯和苯在工业上都可通过石油分馏得到
6.亚硝酸(HNO2)及其钠盐参加反应时既可作氧化剂又可作还原剂。当它们作还原剂时,生成的含氮产物可能是( )
A.NO B.N2 C.NO2 D.NH3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com