
题目列表(包括答案和解析)
3.欲除去CuSO4酸性溶液中少量Fe3+,加入下列试剂效果最好的是
A.氨水 B. NaOH C.H2S水溶液 D.Cu2(OH)2CO3
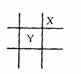 4.元素X和Y在周期表中的相对位置如图所示。已知Y原子最外能层上电子排布为
4.元素X和Y在周期表中的相对位置如图所示。已知Y原子最外能层上电子排布为
nsn-1npn+1,则X的原子序数是
A.8 B.9 C.10 D.16
2.下列物质中不存在配位键的是
A. NH4+ B. [Cu( NH3 )4]2+ C. NH3 D.H3O+
1. 2009年12月7日,《联合国气候变化框架公约》第15次缔约方会议在丹麦首都哥本哈根召开,192个国家和地区的代表出席了会议。此次会议被视为全人类联合遏制全球变暖行动一次很重要努力。能使气候变暖的主要气体是
A.中心原子是以 SP杂化的直线型分子NO2 B.中心原子是以 SP2杂化的∨型分子SO2
C. 中心原子是以 SP杂化的直线型分子H2S D.中心原子是以 SP杂化的直线型分子CO2
30. (16分)下列是芳香族化合物A、B、C、D、E的转化关系,其中A、E分子式分别是C9H8O和C9H8O2,E分子中除苯环外还含有一个六元环,且E中不含甲基。根据下列转化关系回答问题:
(16分)下列是芳香族化合物A、B、C、D、E的转化关系,其中A、E分子式分别是C9H8O和C9H8O2,E分子中除苯环外还含有一个六元环,且E中不含甲基。根据下列转化关系回答问题:
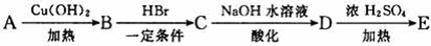
(1)写出A分子中所含官能团的名称____________。
(2)完成方程式,并写出反应类型:
A→B ,反应类型________________________。
B→C________________________,反应类型________________________。
(3)写出E的结构简式____________;写出由D反应生成高聚物的结构简式___________。
(4)D的同分异构体符合下列条件:①苯环有两个取代基;②取代基上无甲基;③能与FeCl3溶液发生显色反应;④能发生水解反应和银镜反应。
写出其中任意一种同分异构体的结构简式________________________。
29.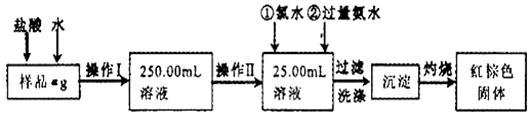 (14分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
(14分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯.玻璃棒.量筒外,还必须有____________ (填自选仪器名称),操作II必须用到的仪器是____________(填编号)。
A.50mL烧杯 B.50mL量筒 C.25mL碱式滴定管 D.25mL酸式滴定管
(2)洗涤是洗去附着在沉淀上的____________。(写离子符号)
(3)检验沉淀是否已经洗涤干净的操作是________________________。
(4)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是____________。
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是____________。
(6)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的。他的理由是________________________。(用化学方程式表示)
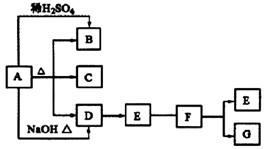
28.(15分)下列A-G均是中学常见化合物,它们之间有如图的转化关系(部分反应物或生成物略去),已知B为一种气体,E、F、G三种化合物中均含有同一种元素M,且价态互不相同。请回答下列问题。
(1)M元素为____________。
(2)B是_________或_________,写出两种鉴 别它们的方法___ _____;____________。
(3)若A与G反应也能制B,且反应中n(A):n(G)=1:2,则此时该反应的离子方程式是_______________________。
(4)若B与F在一定条件下反应生成一种化合物和一种单质,该反应的化学方程式为________________________。
27.(15分)X、Y、Z、W是原子序数依次增大的短周期元素,互不同族,其中只有两种为金属元素;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。Y和W的单质都能与NaOH溶液反应。请回答下列问题:
(1)X元素的名称是_________,Y、Z、W的原子半径由小到大的顺序是________(用元素符号表示)。
(2)W元素在周期表中的位置是__________,Y元素的原子结构示意图是___________。
(3)Z和W在一定条件下能形成化合物ZW2,分子中各原子均达到了8电子稳定结构,则ZW2的电子式是_______;它在常温下呈液态,形成晶体时,属于________晶体。
(4)X的单质与Y的单质化学性质相似,则X的单质与NaOH溶液反应的离子方程式是_______________(注:生成物中,含有X元素的化合物的化学式中含有2个氧原子)
 (5)0.1mol
W的单质与50
mL 1.5 mol·L-1的FeBr2溶液反应,被氧化的Fe2+和Br-的物质的量之比是____________。
(5)0.1mol
W的单质与50
mL 1.5 mol·L-1的FeBr2溶液反应,被氧化的Fe2+和Br-的物质的量之比是____________。
13.铜和镁的合金2.14g完全溶于一定浓度的硝酸,若反应中硝酸被还原为NO2、NO、N2O三种气体且标准状况下体积均为0.224L,在反应后的溶液中,加入足量的氢氧化钠溶液,生成的沉淀经过滤.洗涤.干燥后称量,质量为
A.3.12g B.4.18g C.4.68g D.5.08g
12.在预防甲型H1N1流感疫情时,防疫部门使用了含氯类消毒剂,其中的氯胺是一种长效缓释有机氯消毒剂,有强氧化性,其杀菌能力是一般含氯消毒剂的4-5倍,下列有关氯胺(NH2Cl)的说法一定不正确的是
A.氯胺水解产物为NH2OH(羟氨)和HCl B.氯胺的消毒原理与漂白粉相似
C.氯胺中氯的化合价为+1
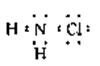
D.氯胺的电子式为
11. 有机物A的结构简式为
,A的同分异构体中带苯环的化合物(烯醇结构除外)共有
有机物A的结构简式为
,A的同分异构体中带苯环的化合物(烯醇结构除外)共有
A.3种 B.4种 C.5种 D.6种
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com