
题目列表(包括答案和解析)
10.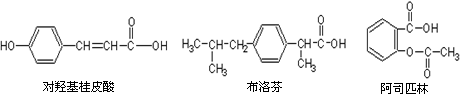 下列三种有机物是某些药物中的有效成分:
下列三种有机物是某些药物中的有效成分:
下列说法正确的是( )
A.三种有机物都能与浓溴水发生反应
B.将等物质的量的三种物质加入氢氧化钠溶液中,阿司匹林消耗氢氧化钠最多
 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
D.使用NaOH溶液和NaHCO3溶液能鉴别出这三种有机物
9.下列实验操作与安全事故处理均正确的是( )
①做银镜反应实验后的试管内壁附有银,可用氨水清洗
②配制一定物质的量浓度的NaCl溶液时,只需使用1次玻璃棒
③欲从碘水中分离出I2,可将适量的CCl4加入碘水中振荡静置分层后分液
④将饱和氯化铁溶液煮沸,可制得氢氧化铁胶体
⑤使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中
⑥用试管夹从试管底由下往上夹住距试管口约1/3处,手持试管夹长柄末端,进行加热
⑦制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中
⑧把玻璃管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻璃管插入端,缓慢旋进塞孔中
A.①③④⑥ B.②⑤⑥⑦  ③⑤⑥⑧ D.⑤⑥⑦⑧
③⑤⑥⑧ D.⑤⑥⑦⑧
8.根据相关的化学原理,下列判断正确的是( )
A.由于水中存在氢键,所以稳定性:H2O>H2S
B.由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2
 若A2+2D-=2A-+D2,则氧化性:D2>A2
若A2+2D-=2A-+D2,则氧化性:D2>A2
D.若R2-和M+的电子层结构相同,则离子半径:R2->M+
7. 8
g Na2O2含有的阴离子数目为0.2 NA
8
g Na2O2含有的阴离子数目为0.2 NA
D.在含4 mol Si-O键的石英晶体中,氧原子的数目为4NA
7.设NA为阿伏加德罗常数,下列有关叙述正确的是( )
A.28 g乙烯和28g丙烯中均含有6NA对共用电子对
B.在熔融状态下,l mol NaHSO4完全电离出的阳离子数目为2NA
6.著名化学家徐光宪,因为在稀土萃取领域取得了卓越成就而获得“国家最高科学技术奖”,被誉为“稀土界的袁隆平”。稀土元素是指镧系的15种元素,加上钪和钇共17种元素。下列说法正确的是 ( )
A.稀土元素全部是金属元素
B.要萃取出碘酒中的碘可以使用氢氧化钠溶液做萃取剂
 镧系元素均属于第七周期、第ⅢB族的元素
镧系元素均属于第七周期、第ⅢB族的元素
D.某些稀土元素在地壳中的含量高于铝
28.(10分)X、Y、Z、Q、E五种元素中,X原子核外的M层中有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在
水中的溶解度较大的是 (写分子式),
(3)Q的元素符号是 ,它属于第 周期,它的外围外电子排布式
为 _________________,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键___________________________________________________________________
29(15分)下表列出前20号元素中的某些元素性质的一些数据:
|
元素 性质 |
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
|
原子半径(10-10m) |
1.02 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
1.17 |
|
最高价态 |
+6 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
|
最低价态 |
-2 |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-4 |
试回答下列问题:
(1)以上10种元素中第一电离能最小的是: (填编号)。
(2) 写出下列有关反应的化学方程式:
① E的单质与I元素的最高价氧化物对应的水化物浓溶液反应:
__________________________________________________________________;
② H2C2与EC2反应:
__________________________________________________________________。
(3)上述E、F、G三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的是 __ (写分子式只写2种)。元素I形成的单质分子中含有_ ______个π键。比元素B原子序数大10的元素基态原子外围电子排布式 。
(4)H--C≡C-CHBr-CH3分子中碳元素原子以 __ 和 __ 杂化成键,分子中共形成 _________个σ键, __________个π键, 是否是手性分子___________
(5)E和I相比较,非金属性强弱,可以验证你的结论的是下列中的 (填编号)。
a.气态氢化物的稳定性 b. 单质分子中的键能
c. 两元素的电负性 d .最高价含氧酸的酸性
辽宁鞍山市第十三中学09-10学年度高二下学期
27.按要求填写(6分)
|
化学式 |
中心原子孤电子对数 |
杂化轨道数 |
杂化轨道类型 |
分子空间构型 |
|
CO2 |
|
|
|
|
|
SO2 |
|
|
|
|
|
BF3 |
|
|
|
|
|
H3O+ |
|
|
|
|
|
CHCl3 |
|
|
|
|
|
SCl2 |
|
|
|
|
26.按要求填空(8分)
(1)Ca周期表中位置______________________________
(2)CO2电子式____________________________________
(3)Fe2+电子排布式________________________________
(4)N电子排布图__________________________________
(5)32Ge外围电子排布式______________周期表中位于__________区
(6)10电子11质子多核微粒的电子式(写两种)______________________________
25.(13分)
(1)向盛有硫酸铜水溶液的试管里逐渐加入氨水,首先产生现象_________,其离子反应方程式____________________________________________________
继续添加氨水,产生现象_____________________________________________,
其离子反应方程式____________________________________________________。
画出配合物离子 [Cu(NH3)4]2+中的配位键__________ __________ 。
在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是________ _______,
(2)分别由第三周期ⅣA族、ⅤA族、 ⅥA族、 ⅦA族四种元素中第一电离能由小到大排列顺序_____________________________________________________(用元素符号)
这四种元素的最高价氧化物对应水化物的酸性由弱到强排列顺序____________________________________________________________(用分子式),
(3)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式:
正四面体分子________________________,三角锥形分子_________________________,V形分子___________________。(各写一种)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com