
题目列表(包括答案和解析)
7. 下列实验方法能达到目的的是w.w.^w.k.s.5*
A. 用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液
B. 用饱和Na2CO3溶液除去乙醇中少量的乙酸和水
C. 取皂化反应后的混合液滴入水中,判断皂化反应是否完全
 D. 用氨水清洗试管内壁附着的银镜
D. 用氨水清洗试管内壁附着的银镜
6. 哥本哈根联合国气候变化大会于2009年12月7日-18日召开,其焦点问题是减少温室气体排放责任共担。本次会议被喻为“拯救人类的最后一次机会”。下列行为中不利于减少温室气体排放的是
A.推广以液化石油气代替天然气作民用燃料
B.改造或淘汰高能耗、高污染产业
C.将二氧化碳加氢转化成甲醇、甲酸等化工原料
D.加快太阳能、风能、核能、海洋能等清洁能源的开发利用
30.(17分)某种存在于茶叶中的有机物A(C9H8O3),其分子中所含的苯环上有2个取代基,取代基上不含支链,且苯环上的一氯代物只有2种;A遇FeCl3溶液发生显色反应。F分子中除了2个苯环外,还有一个六元环。它们的转化关系如下图:
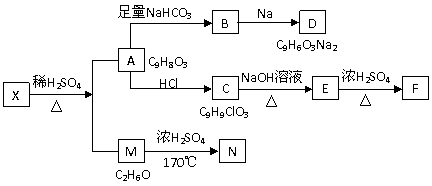
请回答下列问题:
(1)有机物A中含氧官能团的名称是__________________________________;
(2)写出X、F的结构简式X 、F
(3)写出下列反应的化学方程式
A→B:__________________________________________________________;
M→N:_________________________________________________________;
(4)A→C的反应类型为____________,E→F的反应类型为_______________;
(5)1mol A可以和___________mol Br2反应;
(6)某营养物质的主要成分(分子式为C16H14O3)是由A和一种芳香醇R发生酯化反应生成的,则R的同分异构体中含有苯环的有___________种(不包括R);
(7)A→C的过程中还可能有另一种产物C1,请写出C1在NaOH水溶液中反应的化学方程式_____________________________________________________________。
29.( 14 分)在元素周期表中,锌(30Zn)、镉(48Cd)、汞(80Hg)同属于锌族,锌和汞在自然界中常共生,镉的金属活动性介于锌和汞之间。湿法炼锌过程中产生的铜镉渣中含有Cu、Cd、Zn等多种金属,可用于生产金属镉。镉的主要用途可以用作镍―镉电池,以及用于颜料生产,镉化合物还在PVC稳定剂、发光材料、半导体材料、杀菌剂等方面有广泛的应用。镉的生产流程如图示意如下:

请回答下列问题:
(1)镉元素位于周期表中第 周期,第 族,其原子结构示意图为 ;
(2)写出步骤①反应的离子方程式 。
(3)步骤②所加入的金属是 。
(4)步骤④用“溶液2”作电解液,镉在 极析出,该电极材料是
(5)“电解废液”中含有镉,不能直接作为污水排放。目前含镉的废水处理的方式有两种,一种是在含镉污水中加入硫化钠,沉淀镉离子,另一种是加入聚合硫酸铁和聚合氯化铝,沉淀镉离子。写出硫化钠沉淀镉离子的离子方程式 。
28.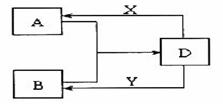 (14分)A、B、D、X、Y是由短周期元素组成的化合物,其中X、Y分别是常见的强酸、强碱。它们存在如下图转化(部分生成物和水略去)。
(14分)A、B、D、X、Y是由短周期元素组成的化合物,其中X、Y分别是常见的强酸、强碱。它们存在如下图转化(部分生成物和水略去)。
(1)若A、B均为气体,在水溶液中反应生成正盐D,其中A是形成酸雨的主要物质。则D的化学式是 。B发生催化氧化反应的化学方程式是 。
(2)若A、B、D含有相同的金属元素,则此元素在元素周期表中的位置是 ,工业上制取该金属单质的化学方程式为: ,现将X滴入B的溶液中至过量,该过程发生的离子方程式为: 。
(3)若A为无色无味的气体,B为盐,且A、B、D三种物质含有相同元素,则A的电子式为: ,A与B溶液反应生成D的离子方程式为: 。
27.(15分)运用化学反应原理研究常见元素的单质及其化合物有重要意义。
(1)合成氨反应N2
(g)+3H2(g) 
 2NH3(g),△H<0。若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大”
“减小”
或“不变”)。
2NH3(g),△H<0。若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大”
“减小”
或“不变”)。
(2)向Na2C2O4溶液加入少量石蕊,溶液显 色,请用离子方程式表示出现该现象的原因: ;
(3)pH相同的氨水和氢氧化钠,分别用蒸馏水稀释至原来溶液的100倍,则稀释后两种溶液的pH分别为m和n,则m n(选填“>”“<”“=”);
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl―NH4Cl为电解质溶液制造新型燃料电池。请写出该电池的正极反应式 。
(5)氢气燃烧热值高。实验测得,在常温常压下,4gH2完全燃烧生成液态水,放出571.6kJ热量,则表示H2燃烧热的热化学方程式为 。
(6)某温度(t℃)时,测得0.01mol・L-1的NaOH溶液的pH=11。在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,且a+b=12,则Va∶Vb= 。
0. 1molNO、0.2molNO2和0.05molN2O4 D.0.6molNO
1molNO、0.2molNO2和0.05molN2O4 D.0.6molNO
13.将Mg和Cu组成的混合物11.2g完全溶解于足量的硝酸中,收集反应产生的x气体。再向所得溶液中加入过量的NaOH溶液,产生21.4g沉淀。根据题意推断气体x的成分可能是( )
A.0.3molNO2 B.0.2molNO2和0.1molN2O4
12. 按如图所示装置进行下列不同的操作,说法不正确的是( )
按如图所示装置进行下列不同的操作,说法不正确的是( )
A.铁腐蚀的速度由大到小的顺序是:只闭合K1>只闭合K3>都断开>只闭合K2
B.只闭合K1,一段时间后,U形管中出现白色沉淀
 只闭合K2,U形管左、右两端液面均下降
只闭合K2,U形管左、右两端液面均下降
D.先只闭合K1,一段时间后,漏斗液面上升,然后再只闭合K2,漏斗液面下降
11.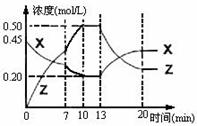 向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)
向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)
 bZ(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。下列说法正确的是( )
bZ(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。下列说法正确的是( )
A.用Y表示0~10min内该反应的平均速率为0.05mol/(L·min)
B.根据上图可求得方程式中a:b=2:1
 0-10min容器内气体的压强逐渐增大
0-10min容器内气体的压强逐渐增大
D.第13min时曲线变化的原因可能是增加了Z的量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com