
题目列表(包括答案和解析)
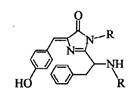
12.美籍华裔科学家钱永健、日本科学家下修村和美国科学家马丁·沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享了2008年诺贝尔化学奖.经研究发现GFP中的生色基团结构如图所示,下列有关说法正确的是( )
(A)该有机物不属于芳香族化合物
(B)1 mol该有机物分子中只有1 mol碳碳双键
(C)该有机物与溴水只能发生加成反应
(D)该有机物不能与稀硫酸反应
11.如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
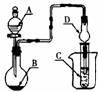 (A)若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
(A)若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
(B)若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液
变浑浊
(C)若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中先产
生白色沉淀后沉淀又溶解
 (D)若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶
(D)若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶
液先变红后褪色
10.镁铝合金5.1g 完全溶于过量的热浓硝酸中,反应中共产生11.2 L NO2(标准状况下测定),若在反应后溶液中加入足量的氢氧化钠溶液,则生成沉淀质量为( )
(A)13.6 g (B)7.8g (C)5.8g (D)4g
9.下列说法正确的是( )
(A)向50 mL 1 mol·L-1明矾溶液中滴入数滴0.1 mol·L-1Ba(OH)2溶液
Al3++2SO42-+2Ba2++3OH- === Al(OH)3↓+2BaSO4↓
(B)金属铁吸氧腐蚀的正极反应为:4OH--4e-= O2↑+ 2H2O
(C)在K2S溶液中加入AgCl固体时反应的离子方程式为:2AgCl+ S2- = 2Cl-+ Ag2S↓
(D)已知乙醇和乙烯的燃烧热分别为1366.8 kJ· mol-1和1411.0 kJ· mol-1,则乙烯水化制乙醇的热化学方程式为: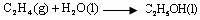 ;
;
ΔH = + 44.2 kJ· mol-1
8.下列各溶液中,微粒的物质的量浓度关系正确的是( )
(A)0.1mol/LNaHCO3溶液中:c(H+)+c(H2CO3)= c(CO32-)+c(OH-)
(B)将稀氨水逐滴加入稀硫酸中,当溶液呈中性时,c(SO42-)>c(NH4 +)
(C)相同温度下,物质的量浓度相同的Ba(OH)2溶液和氨水中c(OH-)之比是2:1
(D)常温下,0.1mol/L某一元酸(HA)溶液中c(OH-)/ c(H+)=1×10-8,该溶液中由水电离出的c(H+)=1×10-3 mol·L-1
7.短周期元素X、Y、Z和W的原子序数依次递增,且在同一周期,四种元素原子的最外层电子数之和为19,X和Y元素原子的原子序数比为6:7,X的最高正价是W的最低负价的绝对值的2倍。下列说法正确的是( )
(A)X单质可以通过铝热法获得
(B)Y的氧化物是良好的半导体材料
(C)Z的氢化物比W的氢化物更稳定
(D)X的最高价氧化物和Z的最高价氧化物化合的产物中有共价键和离子键
6.化学与社会、生活密切相关,下列有关说法正确的是( )
(A)糖类、蛋白质、油脂都可以发生水解反应
(B)要防止水体污染,改善水质,最根本的措施是及时处理排放的工业废水和生活污水
(C)发展混合动力汽车、燃气汽车、醇类燃料汽车、燃料电池汽车、太阳能汽车等清洁汽车,达到节约和替代石油的目的
(D)化学腐蚀和电化学腐蚀都是铁等金属原子失去电子变成阳离子的过程,一般情况下,化学腐蚀比电化学腐蚀要普遍得多
23.过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ.测定过氧化氢的含量
请填写下列空白:
(1)移取10.00 mL密度为r g/mL的过氧化氢溶液至250 mL____________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
□MnO4- +□H2O2+□H+ □Mn2++□H2O+□_____
□Mn2++□H2O+□_____
(3)滴定时,将高锰酸钾标准溶液注入_______(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是__________________________________________________________
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为_____________________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学举小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
|
实 验 内 容 |
实 验 方 法 |
实 验 现 象 |
|
验证氧化性 |
|
|
|
验证不稳定性 |
|
|
|
22.(12分)A-J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。请回答下列问题:
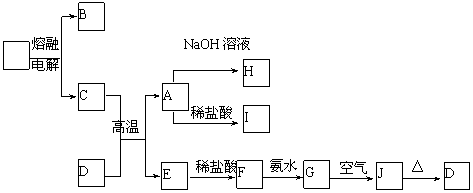
(1)A的化学式为
 (2)H溶液中通入过量的CO2,其反应的离子方程式是
(2)H溶液中通入过量的CO2,其反应的离子方程式是
G→J的化学方程式为
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因
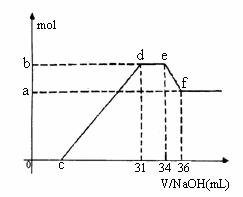
(4)现有一定量C、E混合物与稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4mol /L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。坐标图c点溶液中溶质除C和E的硝酸盐外,还含有的溶质是__________ 其对应物质的量为
21.已知A、B、C、D、E为五种短周期不同主族的元素,其原子序数依次递增。A、E两种原子最外层电子数之和是B原子最外层电子数的2倍;C、E两种原子最外层电子数之和是D原子最外层电子数的2倍。A、E形成的化合物分子甲中电子总数为18,D是地壳中含量最多的元素。回答下列的问题。
(1)甲的电子式为 ,其分子为 分子(填“极性”或“非极性”)
(2)工业生产E元素的单质的化学方程式为 。
(3)A单质与C单质在一定条件下可化合为乙,工业生产乙的条件为 ,室温下,向pH=a的乙的水溶液中加入等体积pH=b的甲的水溶液,且a+b=14,充分作用后,溶液pH 7(填“>”“<”或“=”),该溶液中各种离子浓度由大到小的顺序为 。
(4)C、D两元素可形成多种化合物,其中某一化合物含C元素质量分数为46.67%,写出该化合物的化学式 ,将它转化为C的最高价含氧酸的化学方程式为 。
(5)A、B两元素也可形成多种化合物,其中分子量最小的分子为丙,则丙的空间构型为 。用D的单质和丙可以制成原电池,电池中装有浓KOH溶液,用多孔的惰性电极浸入浓KOH溶液 在X极通入化合物丙,Y极通入D的单质,则X极是该电池的 极,X极的电极反应式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com