
题目列表(包括答案和解析)
16.(12分)
 白云石(主要成分为CaCO4,MgCO2)可用作碱性耐火材料和高炉炼铁的溶制等。
白云石(主要成分为CaCO4,MgCO2)可用作碱性耐火材料和高炉炼铁的溶制等。
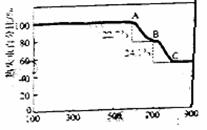
(1)甲同学利用加热法测定白云石中MgCO2的含量,
实验曲线如右图(MgCO4的分解温度比CaCO2
低)
①700℃(即B点)对剩余固体的主要成分为
(填化学式)。
②该白云石中MgCO3的质量分数为
(保留3位有效数字)。
(2)乙同学利用滴定法测定白云石中MgCO3的含量。已知:①滴定时,EDTA分别有Ca2+或Mg2+以物质的量之比1:1进行反应,可用K-B指示剂作为该滴定反应的指示剂;②实验条件下。Mg2+开始沉淀时的pH为10,沉淀完全时的pH为11.2,Ca2+开始沉淀时的pH为12。
步骤1:准确称取白云石试样m g,在烧杯中用适量稀盐酸完全溶解;
步骤2:冷却后全部转移到250mL容量瓶中定容,
步骤3:从容量瓶中移取试液25.00mL,用NaOH溶液调节溶液pH约为9.5;
步骤4:加入2滴K-B指示剂,以c mol/L的EDTA标准溶液滴定至终点,消耗EDTA溶液V1mL;
步骤5:再从容量瓶中移取试液25.00mL, ;
步骤6:加入2滴K-B指示剂,继续以c mol/L的EDTA标准溶液滴定至终点,消耗EDTA溶液V2mL。
①根据上述分析数据,测得该白云石试样中MgCO3的质量分数为 (用含字母的代数式表示)。
②配制100mL c mol/L EDTA标准溶液,需要用到的玻璃仪器有烧杯、玻璃棒、量筒,
。
15.(10分)
一种将CO2变为燃料或有机化学品的构想分成3个步骤:
①利用浓碳酸钾溶液吸收空气中的CO2;
②将第①步吸收液电解产生H2和O2,同时分离出CO2;
③将第②步产生的H2和CO2在一定条件下转化成CH4和H2O2。
已知:H2(g)+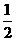 O2(g)=H2O(l) △H1=-285.8kJ/mol
O2(g)=H2O(l) △H1=-285.8kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2=-889.6kJ/mol
H2O(l)=H2O(g) △H3=+44.0kJ/mol
(1)第③步反应的热化学方程式为 。
 (2)若在第②步电解吸收液时产生11.2LO2(标准状况下),则第③步中最多可制得 L甲烷(标准状况下)
(2)若在第②步电解吸收液时产生11.2LO2(标准状况下),则第③步中最多可制得 L甲烷(标准状况下)
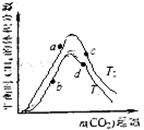
(3)为探究在密闭容器中进行第③步反应的最佳投料比,某
研究小组向恒温(T1、T2均大于100℃)恒容容器中充
入一定量的H2,在其他条件不变的情况下,改变起始
CO2的物质的量测定达到平衡时CH4的体积分数,实
验结果如右图所示。则a、c两点处所的平衡状态中,
氢气的转化率的大小关系是a(a) a(c)(填“>”“<”
或“=”),a、b、c、d四点所处的平衡状态中,对应的
平衡常数Ka、Kb、Kc、Kd的大小关系是 。
(4)H2和CO2在一定条件下也能转化成甲酸。甲酸,空气,质子交换膜和惰性电极组成的燃料电池工作时,负极发生的电极反应可表示为 。
14.(10分)
氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO2-4等杂质)。Cu、稀硫酸,SO2等为原料合成CuCl的工艺如下:
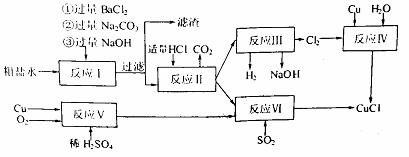
(1)反应I中加Na2CO3溶液的作用是 。
(2)反应II在电解条件下进行,电解时阳极发生的电极反应可表示为 。
(3)写出反应VI的化学方程式 。
(4)反应IV加入的Cu必须过量,其目的是 。
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是 。
13.(12分)高纯氧化铝可用于制高压钠灯的陶瓷管。实验室制取高纯氧化铝的流程如下:
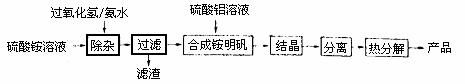
(1)“除杂”操作是加入适量过氧化氢,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。检验Fe2+是否除尽的实验操作是 。
(2)通常条件下,KSP[Fe(OH)3]=4.0×10-36,除杂后溶液中c(Fe3+)= 。
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的是目的是 。
(4)“结晶”操作中,母液经蒸发浓缩至溶液表面刚出现薄层的结晶为止,冷却结晶,得到铵明矾(含结晶水)。母液不能蒸干的原因是 。
(5)“分离”操作名称是 (填字母代号)
A.蒸馏 B.分液 C.过滤
(6)测定铵明矾组成的方法是:
a.称取0.906g铵明矾样品,高温灼烧,得Al2O3残留固体0.1020g;
b. 称取0.4530g铵明矾样品,用适量蒸馏水溶解,再加入稍过量的BaCl2溶液,经陈化、过滤、灰化,得BaSO40.4659g;
c. 称取0.4530g样品,加入足量的NaOH溶液,加热,产生气体依次通过碱石灰和浓硫酸,浓硫酸增重0.0170g。
则铵明矾的化学式为 。
12.现有a mol/L NaX和bmol/L NaY两种盐溶液。下列说法正确的是( )
A.若a=b且c(X-)=c(Y-)+c(HY),则酸性HX>HY
B.若a>b且c(X-)=c(Y-),则酸性HX<HY
C.若a=b且pH(NaX)>pH(NaY),则酸性HX>HY
D.若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)=0.1mol/L,则a=b=0.1mol/L
非选择题
10.用NA表示阿伏加德罗常数的值。下列叙述错误的是 ( )
A.常温常压下,22.4L氮气含有的氮原子数小于2NA
B.15g甲基(-CH3)所含的电子数为7NA
C.标准状况下,密度为dg/L的某气体纯净一个分子的质量为
D.4.6gNa在氧气中完全反应生成Na2O和Na2O2,生成物中阴离子个数为0.1NA
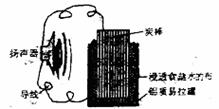 11.某同学利用家中废旧材料制作一个可使玩具扬
11.某同学利用家中废旧材料制作一个可使玩具扬
声器发出声音的电池,装置如右图所示。下列
说法正确的是 ( )
A.电流方向为:
铝质易拉罐→导线→扬声器→导线→炭棒
B.铝质易拉罐将逐渐被腐蚀
C.电池总反应为:4Al+3O2+6H2O=4Al(OH)2
D.炭棒上发生的主要反应为:2H++2e-=H2↑
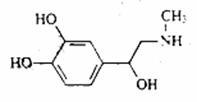
9. 肾上激素是化学信使,随着血液走到身体各处,
肾上激素是化学信使,随着血液走到身体各处,
促使细胞发生变化。它的结构简式如右下图。
下列有关肾上激素的说法正确的是( )
A.分子式为C3H12NO3
B.分子中不含手性碳原子
C.可以发生加成,氧化、消去、取代反应
D.既可以和氢氧化钠溶液反应也可以和盐酸反应
8.某矿石由前20号元素中的4种组成,其化学式为WYZX。X、Y、Z、W分布在三个周期,原子序数依次增大,W、Y为金属元素,X原子的最外以怪电子数是次外层电子数的3倍,W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同周期,Z单质是一种良好的半导体。下列说法正确的是
( )
A.原子半径:W>Y>Z>X
B.气态氢化物的稳定性:X<Z
C.最高价氧化物对应水化物的碱性:Y>W
 D.Y、Z的氧化物都有两性
D.Y、Z的氧化物都有两性
7.下列离子方程式正确的是 ( )
A.向滴有酚酞的硅酸钠溶液中滴加盐酸至浅红色: 2H++SiO2-4=H2SiO3(胶体)
B.酸性条件下KIO3溶液与KI溶液发生反应生成I2: IO-3+5I-+3H2O=3I2+6OH-
C.SO2气体使酸性KMnO4溶液褪色: SO2+4H++MnO-4=SO2-4+Mn2++2H2O
D.银氨溶液与乙醛发生银镜反应:
CH2CHO+2Ag(NH3)+2+2OH-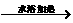 CH3COO-+NH+4+3NH3+2Ag↓+H2O
CH3COO-+NH+4+3NH3+2Ag↓+H2O
6.在下列各溶液中的离子可能大量共存的是 ( )
A.加铝粉放出大量H2的溶液中:Na+、NH+4、SO2-4、Br-
B.常温下,c(H+)/c(OH-)=10-10的溶液中:Ca2+、Mg2+、ClO-、I-
C.0.1mol/LNaHCO4溶液中:K+、Ba2+、OH-、Cl-
D.能使甲基橙变红的溶液中:Na+、K+、SO2-4、AlO-2
不定项选择题:本题包括6小题,每小题4分,共计24分。每小题有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com