
题目列表(包括答案和解析)
12.室温下pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是 ( )
(A)加适量的醋酸钠晶体后,两溶液的pH均增大
(B)使温度都升高20℃后,两溶液的pH均不变
(C)加水稀释2倍后,两溶液的pH均减小
(D)加足量的锌充分反应后,两溶液中产生的氢气一样多
11.下列有关pH变化的判断中,正确的是 ( )
(A)随着温度的升高,NH4Cl和Na2CO3溶液的pH均减小;
(B)随着温度的升高,纯水的pH和KW均增大
(C)新氯水制经光照一段时间后,pH减小
(D)氢氧化钠溶液久置于空气中,pH增大
10.可用于鉴别以下三种化合物的一组试剂是 ( )
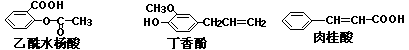
①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④氢氧化钠溶液
(A)②与③ (B)③与④ (C)①与④ (D)①与②
9.下列各组试剂在溶液中反应,当两种试剂的量发生改变时,可用同一离子方程式表示的 ( )
(A)二氧化硫、氢氧化钠 (B)硫酸氢钠、氢氧化钡
(C)氯化铝、氨水 (D)溴化亚铁、氯水
8.甲、乙两元素原子的L层电子数都是其它层电子总数的2倍。下列推断正确的是( )
(A)甲与乙处于同一周期 (B)甲与乙处于同一主族
(C)甲与乙的单质都是原子晶体 (D)甲与乙的原子序数之和为偶数
7.相等物质的量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热分解得到氧气;②若不使用催化剂,加热至470℃左右,得到KClO4(高锰酸钾)和KCl。下列关于①和②的说法不正确的是 ( )
(A)都是氧化还原反应 (B)发生还原反应的元素相同
(C)发生氧化反应的元素不同 (D)生成KCl的物质的量相同
6.某校学生用化学知识解决生活中的问题,下列家庭小实验不合理的是 ( )
(A)用食醋除去暖水瓶中的薄层水垢
(B)用米汤检验含碘盐中的碘酸钾(KIO3)
(C)用食用碱热溶液洗涤餐具上的油污
(D)用灼烧并闻气味的方法区别纯棉织物和纯毛织物
19.(12分)
 本题包括A、B两小题,分别对应“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内作答。若两题都做,将按A题评分。
本题包括A、B两小题,分别对应“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内作答。若两题都做,将按A题评分。
A. 氢气是重要而洁净的能源,
B. 要利用氢气作能源,必须安
C. 全有效地储存氢气。
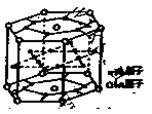
(1)某种铜镍合金材料有较大的储氢容量,
其晶体结构如图所示。这种合金中La与Ni
的原子个数比为 ;其中基态Ni
原子的核外电子排布式为 。
(2)氢元素可与其他四种短周期元素a、b、c、d、e、f、g等七种微粒,它们都有10个电子,其填结构特点如下表:
|
微粒 |
a |
b |
c |
d |
e |
f |
g |
|
原子核数 |
双核 |
双核 |
三核 |
四核 |
四核 |
五核 |
五核 |
|
所带单位电荷 |
0 |
-1 |
0 |
0 |
+1 |
|
+1 |
①与c互为等电子体的一种阴离子是 (填化学式);
②微粒中中心原子的杂化方式为 杂化。
③比较相同条件下a与f在水中的溶解度:a f(填“>”、“=”或“<”)
 ④Ni2+可与d形成配位数为6的配离子,该配离子的化学式为 。
④Ni2+可与d形成配位数为6的配离子,该配离子的化学式为 。
B.实验室通常以环已醇为原料在浓硫酸作用下脱水来制备环己烯。
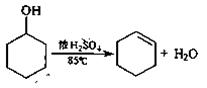
实验步骤下:
①在25mL干燥的圆底烧瓶中加入10g环己醇和0.5mL 98%浓硫酸,充分振荡。
②向烧瓶中放入2~3粒沸石,安装分馏装置,接收瓶用冰水冷却。
③小心加热,控制加热速度使温度不超过90℃,直到瓶底剩余少量残渣并出现白雾时停止加热。(已知:环己烯,沸点82.98℃;环己烯-10%水,沸点70.8℃;环己醇-80%水,沸点97.8℃:环己醇-30.5%环己烯,沸点64.9℃)
④向馏出液中加约1g精盐使其达饱和,然后加入2mL饱和碳酸钠水溶液,充分振荡。
⑤……
⑥有机层倒入干燥的小锥形瓶中,加入1~2g无水氯化钙干燥。待溶液清亮透明后过滤。
⑦将滤液移入圆底烧瓶中,加入2~3粒沸石,蒸馏。收集80~85℃馏分,称重约7.4g。
⑧计算。
请回答下列问题:
(1)步骤①中,加入10g环已醇和0.5mL 98%浓硫酸的顺序是 ;
(2)步骤③中,为便干控制加热温度,应该采取的加热方法是 ;
(3)步骤④中,向馏出液中加约1g精盐使其达饱和的目的是 ;
(4)步骤⑤的操作是 ;
(5)步骤⑧计算得到的环己烯的产率为 ;分析实制得的环己烯质量低于理论产量可能的原因是 。
18.(10分)一氧化碳是一种重要的化工原料。
(1)高炉炼铁中发生的反应之一是:

 FeO(s)+CO(g) Fe(s)+CO2(g) △H=-1kJ/mol。
FeO(s)+CO(g) Fe(s)+CO2(g) △H=-1kJ/mol。
温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比将
(填“增大”、“减小”或“不变”)。
已知1100℃时,该反应平衡常数K=0.263,现测得高炉中(CO2)=0.025mol/L,c(CO)=0.1mol/L,此时该反应 .
A.向正反应向向进行 B.处于平衡状态 C.向逆反应方向进行
(2)合成氨工业中需将原料气中的CO变成CO2除去。在密闭密器中将CO和H2O混合加热到800℃,达到下列平衡:
 CO(g)+H2O(g)
CO2(g)+H2(g) K=1.0
CO(g)+H2O(g)
CO2(g)+H2(g) K=1.0
若平衡时n(H2O)/n(CO)=1,则CO转化为CO2的转化率为 。
(3)用CO和H2经如下两步反应制得甲酸甲醛:
CO+2H2→CH3OH
CO+CH3OH→HCOOCH2
已知反应①中CO的转化率为80%,反应②中两种反应物的转化率均为85%,则2.52;CO最多可制得甲酸甲醛多少吨?(写出计算过程)。
17.(12分)
班布特罗是一种用于治疗小儿支气管哮喘的药物。它的合成路线如下(ph-表示苯基):
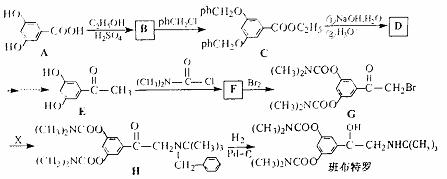
回答下列问题:
(1)A与过量的NaHCO3溶液反应的化学方程式为 。
(2)F的结构简式为 。
(3)写出满足下列条件的E的一种同分异构体的结构简式 。
①苯的邻二取代物;
②不能与FeCl4溶液发生显色反应;
③水解产物能发生银镜反应。
(4)由G与X(C11H17N)发生取代反应生成H,则X的结构简式为 。
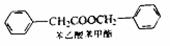 (5)苯乙酸苯甲酯可用作花香型日用香精。请设计合理
(5)苯乙酸苯甲酯可用作花香型日用香精。请设计合理
方案以甲苯为原料合成苯乙酸苯甲酯(用合成路
线流程图表示,并注明反应条件), 。
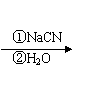
提示:①R-Cl R-COOH
②合成过程中无机试剂任选;
③合成路线流程图示例如下:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com