
题目列表(包括答案和解析)
4. 下列实验中,所加物质的浓度不会影响实验现象的是( )
A.向Fe(OH)3胶体中滴加HCl,先出现沉淀,后沉淀溶解
B.向少量苯酚溶液中滴入溴水,有白色沉淀产生
C.向盛有少量MnO2的烧瓶中加入盐酸,加热,有黄绿色气体产生
D.向盛有少量铜片的试管中加入H2SO4,加热,有气体放出
3.
 红曲色素是通过中国传统工业发酵得到的天然色素,用作食品色素安全性很高,同时具有抑菌、防腐和保健作用。其中一种成分--红斑红素结构如图所示,下列有关红斑红素的说法正确的是( )
红曲色素是通过中国传统工业发酵得到的天然色素,用作食品色素安全性很高,同时具有抑菌、防腐和保健作用。其中一种成分--红斑红素结构如图所示,下列有关红斑红素的说法正确的是( )
A.分子中环上的所有原子都在同一平面上
B.既能发生银镜反应,又能被氢气还原
C.1 mol该物质能与5 mol Br2发生加成反应
D. 1 mol 该物质水解时能消耗2 mol NaOH
2. 下列说法正确的是( )
A.4.0g碳化硅晶体中所含C-Si数为0.4NA
B. PCl3、BF3、HClO这些分子中每个原子都达到了8电子结构
C.电解精炼铜时,当阳极质量减少3.2 g时,电路中转移的电子数为0.1NA
D.若H+(aq) + OH-(aq)= H2O(l);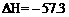 kJ·mol-1,则含Ba(OH)2 1 mol溶液与1 mol稀H2SO4反应放出的热量为114.6 kJ
kJ·mol-1,则含Ba(OH)2 1 mol溶液与1 mol稀H2SO4反应放出的热量为114.6 kJ
1. 下列叙述中,正确的是( )
①汽车尾气中的氮氧化物与光化学烟雾的形成有关
②大量燃烧含硫燃料是形成酸雨的主要原因
③棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O
④减少CO2排放,可遏制全球气候变暖
⑤纯铁比碳素钢易生锈
A.①③⑤ B.①②④ C.②④⑤ D.②③④
30. (10分)为了探究促进有丝分裂的物质对细胞分裂的促进作用,将小鼠的肝细胞悬浮液分成等细胞数的甲、乙两组,在甲组培养液中加入3H标记的胸腺嘧啶脱氧核苷(3HTdR);乙组中加入等剂量的3HTdR,并加入促进有丝分裂的物质。培养一段时间后,分别测定甲、乙两组细胞的总放射强度。据此完成下列问题:
(1)小鼠细胞内3HTdR参与合成的生物大分子是__________,该种分子所在的细胞结构名称是___________。
(2)乙组细胞的总放射性强度比甲组的高,原因是__________________________。
(3)细胞利用3HTdR合成生物大分子的过程发生在细胞周期的_______期。
(4)在上述实验中选用3HTdR的原因是_____________________________。
29.(15分)
(1)某芳族化物A由碳、氢、氧三种元素组成,其蒸气密度是相同条件下H2密度的69倍。已知0.1 molA在氧气中完全燃烧得30.8gCO2和0.3mol H2O, 则A的分子式是____________。
A可以与NaHCO3溶液反应、其苯环上有两个邻位的取代基,则A中含氧官能团的名称是
|

(2)A可以与 反应制得有机物B(分子式为C9H9O4,遇FeCl3溶液不能显色),该反应的化学方程式是____________________________________
反应制得有机物B(分子式为C9H9O4,遇FeCl3溶液不能显色),该反应的化学方程式是____________________________________
(3)已知下列下列信息。分子式为C3H4的烃可以发生下图转化:


其中E、F均呈酸性。F可以与有机物B和乙二醇共同发生反应得到有机物G,由G通过加聚反应可以进一步合成分子式为(C15H15O6)2的药物H。
①写出F的同分异构体结构简式,且满足a)属于链状酯类、b)分子中每个碳原子上都连有氢原子___________________________________________
②C→D的化学方程式是_________________________________
③H的结构简式是_______________________________
28.(16分)
 [Ⅰ] 硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验由废铁屑(含Fe2O3)制备FeSO4·7H2O晶体过程如下: (铁屑先用Na2CO3溶液洗涤去除了油污)
[Ⅰ] 硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验由废铁屑(含Fe2O3)制备FeSO4·7H2O晶体过程如下: (铁屑先用Na2CO3溶液洗涤去除了油污)
(1)铁屑溶解时发生主要反应的离子方程式____________________________
(2)有关制备中的分析错误的是_______
①铁屑需过量放可除去产生的Fe3+且利于防止产生Fe3+;②趁热过滤目的是加快过滤速度;③硫酸过稀致使溶液浓度过低不利于晶体大量析出;④冰水洗涤能减少晶体的溶解损失;⑤控制温度50)C-80)C利于制成饱和溶液,加速铁屑的溶解;
(3)检验滤液中是否含有的Fe3+方法是_____________________________________
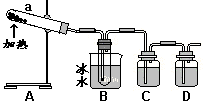 [Ⅱ]硫酸最古老工业生产方法是“铅室法”:以绿矾为原料,在铅制蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O
[Ⅱ]硫酸最古老工业生产方法是“铅室法”:以绿矾为原料,在铅制蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O Fe2O3+SO3↑+SO2↑+14H2O↑。抽出混合气体冷凝便得到浓硫酸。
Fe2O3+SO3↑+SO2↑+14H2O↑。抽出混合气体冷凝便得到浓硫酸。
用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和SO2。
(4)① 试管b中得到的主要产物是___________,
② 为检验SO2生成物,试管c中应加入的试剂
是__________
③ B中所得硫酸的理论浓度(溶质的质量分数)为_________
(5)这一古老的制备方法被淘汰,除原料有限和能耗较高还可能原因有____________
27. (15分)已知化合物A与B,M与N的元素组成相同,且四种物质中含有同一种元素,A与B在常温下均呈液态。D为常见金属单质,少量D与足量X的浓溶液在常温下无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)
(15分)已知化合物A与B,M与N的元素组成相同,且四种物质中含有同一种元素,A与B在常温下均呈液态。D为常见金属单质,少量D与足量X的浓溶液在常温下无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)
(1)A的结构式 ,E的化学式为 ;试卷
(2)在①至⑥的化学反应中,属于氧化还原反应的化合反应为 (填反应序号)
(3)写出下列反应的化学方程式② ④ 试卷
26.(14分)短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
|
元素 |
有关信息 |
|
X |
最外层电子数是次外层的2倍 |
|
Y |
元素主要化合价为-2价 |
|
Z |
其单质及化合物的焰色为黄色 |
|
M |
与X同主族,其单质为半导体材料 |
|
N |
其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
 (1)XY2的电子式是_________;Z2Y2中所含化学键类型是________;XY2与Z2Y2反应的化学方程式是_______
(1)XY2的电子式是_________;Z2Y2中所含化学键类型是________;XY2与Z2Y2反应的化学方程式是_______
(2)恒容条件下,一定量的NY2、Y2发生反应:
2NY2(g)+Y2(g) 2NY3(g)。温度分别为T1和T2时,
2NY3(g)。温度分别为T1和T2时,
NY3的体积分数随时间变化如右图,该反应的△H 0(填
“>”“<”或“=”,下同);若甲乙两容器相同,充入如图
 相应量的反应物,甲、乙均恒温不变,反应过程中甲保持
相应量的反应物,甲、乙均恒温不变,反应过程中甲保持
体积不变,乙保持压强不变,反应达平衡时下列分析正确
的是_________
a.乙中NY2转化率大于甲 b.乙中NY3体积分数大于甲;
c.乙中 NY3物质的量为甲的2倍 d.甲、乙中NY2转化率相同;
(3)X的非金属性比M______(填“强”或“弱”),能证明此结论的事实是_______
(用一离子方程式表示)。
13.常见到的标记为Li-ion的电池称为“锂离子电池”。其负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传到Li+的高分子材料。这种锂离子电池的电池反应为:Li+2Li0.35NiO2 2Li0.85NiO2。
2Li0.85NiO2。
下列说法正确的是 ( )
(A)放电时,负极的电极反应式为:LI++e- = Li;
(B)充电时,Li发生氧化反应
(C)该电池不能用水溶液作为电解质;
(D)放电过程中Li+ 向负极移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com