
题目列表(包括答案和解析)
15.下列关于化工生产原理的叙述中,不符合目前工业生产实际的是( )
(A)为充分利用原料,在氯碱工业、合成氨工业和纯碱工业的生产过程中均采用了原料循环使用的工艺
(B)通过电解Fe2O3-SiO2-CaO的熔融液(1600℃)来大规模地冶炼铁
(C)生产重要的化工原料氯化氢是将氯气在氢气中点燃充分燃烧来获得的
(D)用不同的碱溶液来吸收硫酸、硝酸工业中的尾气,其目的都包含着既防止有害气体的排放,同时又生产出一些有用的化工辅料,充分体现了“绿色化学”的理念
14.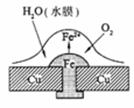 铜板上铁铆钉若较长时间地浸泡在海水中会生锈甚至腐烂,其腐蚀原理如右图所示。下列有关此过程的说法不正确的是( )
铜板上铁铆钉若较长时间地浸泡在海水中会生锈甚至腐烂,其腐蚀原理如右图所示。下列有关此过程的说法不正确的是( )
(A)正极上的主要电极反应式为:2H2O + O2 + 4e → 4OH-
(B)此过程中铜并未被腐蚀
(C)此过程中会有微小电流从Fe移向Cu
(D)此过程中还可能涉及到反应:4Fe(OH)2+2H2O+O2 → 4Fe(OH)3
13.“人文奥运”的一个体现是“严厉禁止运动员服用兴奋剂”。某兴奋剂的结构简式如下图,下列有关它的说法正确的是( )
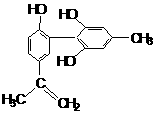 (A)该分子中的所有碳原子有可能是共平面的
(A)该分子中的所有碳原子有可能是共平面的
(B)该物质属于苯酚的同系物
(C)该物质能与小苏打溶液反应放出CO2
(D)该物质的分子式为C16H15O3
12.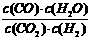
 高温下某反应达到平衡,其平衡常数的表达式是:K=
。
高温下某反应达到平衡,其平衡常数的表达式是:K=
。
现采取了某一措施,并在过段时间后测得H2的浓度有所增大。由此得到的结论一定正确的是 ( )
(A)该反应的化学方程式为:CO+H2O CO2+H2
(B)无论采取怎样的措施该体系中混合气体的平均分子量都不会发生改变
(C)采取的措施一定是改变了温度,并使平衡朝着生成H2的方向移动
(D)采取的措施可能是改变了压强而导致H2的浓度有所增大
11.常温时,将V1mL c1 mol/L的氨水滴加到V2mL c2 mol/L的盐酸中,下列结论中正确的是( )
(A)若混合溶液的pH=7,则一定存在c1V1>c2V2 关系
(B)若V1=V2,c1=c2,则溶液中一定存在c(H+)= c (OH-),呈中性
(C)若混合溶液的pH=7,则溶液中c (NH4+)> c (Cl-)
(D)若V1=V2,并且混合液的pH<7,则一定是由于盐酸过量而造成的
10.在含有H+、NO3-、Fe3+、Cu2+、SO42-等五种离子的较稀溶液中逐量地加入铁粉,上述微粒相继共有四个反应发生,理论上说最后一个出现的反应是( )
(A)2 Fe3++Fe→ 3 Fe2+ (B)4H++NO3-+Fe →Fe3++NO↑+2H2O
(C)Cu2++Fe→ Fe2+ +Cu (D)2H++Fe → Fe2++H2↑
9.下列分析推断有错误的是( )
(A)“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量低
(B)某温度下,在饱和食盐水中若通入HCl气体会看到白色沉淀析出
(C)将不规则外形的硫酸铜晶体投入饱和硫酸铜溶液中,通过观察晶体外形的变化及固体质量保持不变,能证明溶解平衡是一个动态平衡
(D)向氯化银固体中加入KI溶液,一段时间后固体由白色变成黄色,说明同温度下溶解度大小的关系是:S(AgI)﹤S(AgCl)
8.某稀溶液中含有HCO3- 、SO32-、CO32-、CH3COO-、NH4+、Na+等多种阴、阳离子。若向其中加入适量的Na2O2固体后,你认为原溶液中离子浓度基本保持不变的微粒会有( )种
(A)3 (B)2 (C) 1 (D)无,都有变化
7.下列各反应式中,能表现出氨既具有还原性又具有碱性的是( )
(A)8NH3 + 3Cl2 → N2+ 6NH4Cl (B)NH3 + HNO3 → NH4NO3
(C)2NH3 + 3Mg → Mg3N2 + 3H2 (D)3CuO + 2NH3 →3Cu+3H2O + N2
6.下列每组物质发生状态变化所克服的微粒间的相互作用属同种类型是( )
(A)食盐和蔗糖的熔化 (B)白磷和斜方硫的熔化
(C)氯化铵固体和干冰受热后的气化 (D)氧化镁和金属镁的熔化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com